题目内容
12.下列说法正确的是( )| A. | 在水中能电离出离子的化合物一定是离子化合物 | |
| B. | CO2分子中含极性键,且溶于水能导电,所以CO2是电解质 | |
| C. | Ca(OH)2微溶于水,所以是弱电解质 | |
| D. | CH3COOH在水中只能部分电离,所以是弱电解质 |
分析 A、离子化合物和部分共价化合物水溶液中可以电离出离子;
B、电解质是水溶液中或熔融状态都导电的化合物,是自身电离出离子;
C、水溶液中部分电离的电解质为弱电解质,和物质溶解度无必然联系;
D、醋酸水溶液中部分电离属于弱电解质;
解答 解:A、离子化合物和部分共价化合物水溶液中可以电离出离子,如共价化合物HCl溶于水电离出氢离子和氯离子,故A错误;
B、电解质是水溶液中或熔融状态都导电的化合物,是自身电离出离子,二氧化碳溶于水溶液导电是因为二氧化碳和水反应生成了电解质,二氧化碳属于非电解质,故B错误;
C、水溶液中部分电离的电解质为弱电解质,和物质溶解度无必然联系,氢氧化钙水溶液中完全电离属于强电解质,故C错误;
D、醋酸是弱酸在水溶液中部分电离,属于弱电解质,故D正确;
故选D.
点评 本题考查了物质分类,电解质、非电解质、弱电解质、强电解质概念的分析理解,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
2.下列各组物质中属于同分异构体的是( )
| A. | 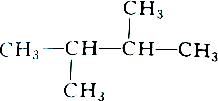 和 和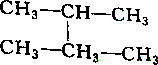 | B. | 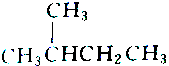 和 和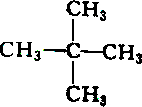 | ||
| C. | 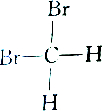 和 和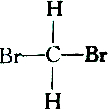 | D. | 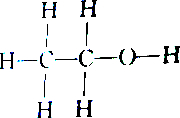 和 和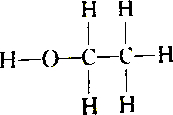 |
3.将H2S和SO2气体分别通入下列溶液中,只有一种气体反应是( )
| A. | 溴水 | B. | 酸性KMnO4 | C. | 浓HNO3 | D. | CuSO4溶液 |
20.一定量的锌片与过量2mol•L-1的盐酸跟反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A. | 通入一定量的HCl气体 | B. | 加入数滴氯化铜溶液 | ||
| C. | 加入一定量6mol•L-1的硝酸溶液 | D. | 加入适量的CH3COONa固体 |
7.已知短周期元素形成的离子aA+、bB2+、cC-、dD2-均具有相同的电子层结构,下列判断正确的是( )
| A. | 元素的金属性:B>A;元素的非金属性:D>C | |
| B. | 原子序数:b>a>c>d | |
| C. | 离子半径:D2->C->B2+>A+ | |
| D. | 原子半径:A>B>C>D |
17.强酸和强碱的稀溶液发生中和反应的热效应:
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ•mol-1
向1L0.5mol/L的NaOH溶液中分别加入①稀醋酸、②浓硫酸、③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3、它们的关系正确的是( )
H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ•mol-1
向1L0.5mol/L的NaOH溶液中分别加入①稀醋酸、②浓硫酸、③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3、它们的关系正确的是( )
| A. | △H1>△H2>△H3 | B. | △H2<△H3<△H1 | C. | △H1=△H2=△H3 | D. | △H1<△H3<△H2 |
4.下列说法正确的是( )
| A. | Li是最活泼金属,F是最活泼非金属 | |
| B. | Mg(OH)2碱性比Ca(OH)2强 | |
| C. | PH3比HF稳定 | |
| D. | X2+的核外电子数目为18,则X在第四周期第ⅡA族 |
1.下列各组物质中化学键的类型相同的是( )
| A. | CaCl2 MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
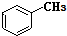 和
和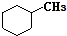 .其中互为同分异构体的是①③④(填序号).
.其中互为同分异构体的是①③④(填序号).