题目内容
8.关于某溶液所含离子检验的方法和结论正确的是( )| A. | 加入BaCl2溶液有白色沉淀生成,加稀盐酸沉淀不消失,原溶液一定有SO42- | |
| B. | 加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,原溶液一定有Cl- | |
| C. | 加入盐酸产生能使澄清石灰水变浑浊的气体,原溶液中可能有CO32-或SO32- | |
| D. | 加入NaOH并加热,产生使湿润蓝色石蕊试纸变红的气体,原溶液是铵盐溶液 |
分析 A.能和BaCl2溶液混合产生白色沉淀且白色沉淀不溶于盐酸的物质中可能含有Ag+或SO42-;
B.能和AgNO3溶液产生白色沉淀且白色沉淀不溶于稀盐酸的离子可能为Cl-或SO42-;
C.能使澄清石灰水变浑浊的气体可能是二氧化硫或二氧化碳;
D.加入NaOH并加热,产生使湿润蓝色石蕊试纸变红的气体,原溶液可能是铵盐或氨水.
解答 解:A.能和BaCl2溶液混合产生白色沉淀且白色沉淀不溶于盐酸的物质中可能含有Ag+或SO42-,所以原溶液可能含有SO42-,故A错误;
B.能和AgNO3溶液产生白色沉淀且白色沉淀不溶于稀盐酸的离子可能为Cl-或SO42-,所以原溶液中可能含有Cl-,故B错误;
C.能使澄清石灰水变浑浊的气体可能是二氧化硫或二氧化碳,能和稀盐酸生成二氧化碳的离子有HCO3-和CO32-,能和稀盐酸反应生成二氧化硫的离子有HSO3-和SO32-,所以原溶液中可能有CO32-或SO32-,故C正确;
D.加入NaOH并加热,产生使湿润蓝色石蕊试纸变红的气体,原溶液可能是铵盐或氨水,所以原溶液不一定是铵盐溶液,故D错误;
故选C.
点评 本题考查化学实验方案评价,侧重考查离子检验,明确离子检验方法及实验现象是解本题关键,注意排除其它离子的干扰,易错选项是D.

练习册系列答案
相关题目
18.下列关于化学反应限度的说法中正确的是( )
| A. | 一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 | |
| B. | 当一个可逆反应达到平衡状态时,正反应速率和逆反应速率相等,都等于0 | |
| C. | 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |
19.水溶液中能大量共存的一组离子是( )
| A. | K+、NH4+、OH-、SO42- | B. | H+、Fe2+、SO42-、ClO- | ||
| C. | Na+、Ca2+、Cl-、CO32- | D. | K+、Ca2+、Cl-、NO3- |
13.已知断裂1mol共价键所需要吸收的能量分别为:H-H:436kJ,I-I:151kJ,H-I:299kJ,下列对H2(g)+I2(g)?2HI(g)的反类型判断错误的是( )
| A. | 放热反应 | B. | 吸热反应 | C. | 氧化还原反应 | D. | 可逆反应 |
17.现已知O3分子为V字形结构,O3在水中的溶解度和O2比较要大或小( )
| A. | O3在水中的溶解度和O2一样 | B. | O3在水中的溶解度比O2小 | ||
| C. | O3在水中的溶解度比O2要大 | D. | 没办法比较 |
18.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | CO2 SO2 | B. | C2H4 CH4 | C. | C60 C2H4 | D. | NH3 HCl |
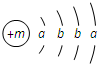 某种融雪剂,其主要成分的化学式为XY2,图为X原子的结构示意图,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
某种融雪剂,其主要成分的化学式为XY2,图为X原子的结构示意图,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.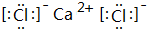 .
.