题目内容
8.已知:一般溶液浓度越大密度越大,氨水等例外.则体积为vL、质量为mg,浓度为a mol/L的氨水溶液的溶质质量分数为b%,用水稀释到0.5a mol/L,下列说法正确的是( )| A. | 加水的体积为vL | |
| B. | 加水的质量为mg | |
| C. | 0.5amol/L的氨水质量分数等于0.5b% | |
| D. | 0.5amol/L的氨水质量分数小于0.5b% |
分析 根据稀释定律计算稀释后溶液的体积,结合m=ρV、溶液密度判断稀释后溶液的质量,进而确定水的质量,根据c=$\frac{1000ρω}{M}$、结合溶液密度判断质量分数.
解答 解:a mol/L的氨水溶液的密度为dg/mL,0.5a mol/L的氨水溶液的密度为D g/mol,则d<D,
根据稀释定律,稀释后溶液的体积为$\frac{vL×amol/L}{0.5amol/L}$=2v,则稀释后溶液质量大于2mg,故加入水的质量大于mg,稀释后溶液的体积不等于浓氨水的体积与水的体积之和,则加入水的体积不是V L,
设0.5a mol/L氨水的质量分数为w,根据c=$\frac{1000ρω}{M}$可知,a=$\frac{1000d×b%}{17}$,0.5a=$\frac{1000D×w}{17}$,结合d<D,联立可得0.5a<0.5b%,
综上分析可知,ABC错误,D正确,
故选D.
点评 本题考查溶液浓度计算,涉及物质的量浓度、质量分数计算,注意理解掌握物质的量浓度与质量分数之间的关系,难度中等.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
18.下列说法正确的是( )
| A. | 随原子序数递增,ⅦA族元素的最高价氧化物对应水化物酸性逐渐增强 | |
| B. | 第三周期元素中(除稀有气体元素)简单离子半径最小的元素,其氧化物具有两性 | |
| C. | 第三周期气态氢化物的沸点均为同主族中沸点最低的,是因为其分子内含有氢键 | |
| D. | 第二周期元素(除稀有气体元素)的最高化合价数值逐渐增大 |
16.向含有FeCl3和BaCl2的酸性溶液中通入足量的SO2,有白色沉淀生成,向过滤后的滤液中滴入KSCN溶液,无明显现象,由此得出的正确结论是( )
| A. | 白色沉淀是BaSO3 | B. | 白色沉淀是BaSO3和BaSO4的混合物 | ||
| C. | 白色沉淀是BaSO4 | D. | FeCl3已全部被氧化为FeCl2 |
3.下列实验不能达到目的是( )
| A. | 向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 | |
| B. | 只用少量水就可鉴别Na2CO3和NaHCO3固体 | |
| C. | 用FeSO4、NaOH和盐酸等试剂在空气中可以制备较纯净的FeCl3溶液 | |
| D. | 用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
13.某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如图所示:
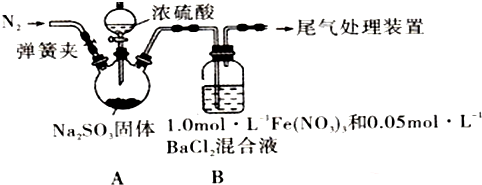
已知:l.0mol•L-1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O.
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是关闭分液漏斗活塞,打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.
(3)装置B中产生了白色沉淀,其成分是BaS04,说明SO2具有还原性.
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO${\;}_{3}^{-}$反应;
猜想3:…
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色.
【得出结论】:猜想1成立.其结论正确吗?否(填是或否).
若不正确,理由是可能SO2过量,溶解的SO2也能使KMnO4溶液褪色(正确无需回答).
(5)乙同学设计实验验证猜想2,请帮他完成下表中内容(提示:NO${\;}_{3}^{-}$在不同条件下的还原产物较复杂,有时难以观察到气体产生.除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等.)
(6)在实际操作中,当SO2通入Fe(NO3)3溶液时观察到的现象;溶液由黄色变为浅绿色,接着又变为黄色,请用相关离子方程式表示其过程SO2+2Fe3++2H2O=SO42-+2Fe2++4H+、3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.

已知:l.0mol•L-1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O.
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是关闭分液漏斗活塞,打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.
(3)装置B中产生了白色沉淀,其成分是BaS04,说明SO2具有还原性.
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO${\;}_{3}^{-}$反应;
猜想3:…
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色.
【得出结论】:猜想1成立.其结论正确吗?否(填是或否).
若不正确,理由是可能SO2过量,溶解的SO2也能使KMnO4溶液褪色(正确无需回答).
(5)乙同学设计实验验证猜想2,请帮他完成下表中内容(提示:NO${\;}_{3}^{-}$在不同条件下的还原产物较复杂,有时难以观察到气体产生.除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等.)
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ①用NaNO3和盐酸配成pH=1, C(NO3-)=3mol•L-1的溶液,并替换装置B中的Fe(NO3)3溶液. ②打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.再打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸. | 若装置B中有白色沉淀生成,猜想2成立.否则,猜想2不成立. |
20.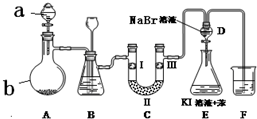 实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
(1)a、b两仪器的名称是:a分液漏斗;b圆底烧瓶.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体 主要成分为Ca(ClO)2和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c.
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明非金属性氯大于溴(填“大于”或“小于”).
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
 实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).(1)a、b两仪器的名称是:a分液漏斗;b圆底烧瓶.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体 主要成分为Ca(ClO)2和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
17.下列说法或做法正确的是( )
| A. | 用蒸发皿加热蒸发溶液时,盛液体的量不能超过其容积的$\frac{1}{3}$ | |
| B. | 用托盘天平可称10.50g K2SO4晶体 | |
| C. | 用10mL量筒量取8.50mL稀H2SO4溶液 | |
| D. | 加热坩埚不需要垫石棉网 |
18.下列说法中正确的是( )
| A. | 氨能在空气中燃烧,生成N2和水 | |
| B. | NO2溶于水生成HNO3,NO2属于酸性氧化物 | |
| C. | 所有的铵盐加热分解都能产生NH3 | |
| D. | 铜与浓硝酸反应时,硝酸既表现氧化性又表现酸性 |
 .
.