题目内容
4.(1)对于A+2B(g)?nC(g),△H<0.在一定条件下达到平衡后,改变下列条件,请回答:①A量的增减,平衡不移动,则A为固或液态.
②增压,平衡不移动,当n=2时,A为固或液态;当n=3时,A为气态.
③若A为固态,增大压强,C的组分含量减少,则n>2.
④升温,平衡向右移动,则该反应的逆反应为放热反应.
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应的中和热为△H=-57.3 kJ/mol,表示该中和热的热化学方程式为$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol.
(3)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的大小关系为△H3>△H2>△H1.
(4)已知下列反应的反应热:
①CH3COOH(l)+2O2(g)═2CO2 (g)+2H2O(l)△H=-870.3kJ∕mol
②C(S)+O2(g)═CO2 (g)△H=-393.5kJ∕mol
③2C(S)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3kJ∕mol
请写出H2燃烧热的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ∕mol.
分析 (1)①固体物质,物质的量增加减少不影响化学平衡;
②反应物、生成物气体体积不变,化学计量数之和相等;
③增大压强,平衡向着体积减小的方向移动;
④升高温度,化学平衡向着吸热方向移动;
(2)根据中和热的定义计算反应热;
(3)浓硫酸溶于水放热,醋酸为弱电解质,溶于水吸热;
(4)已知①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H=-870.3kJ•mol-1,
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,
③2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3kJ•mol-1,
由盖斯定律可知,①-②×2+③计算,注意物质的聚集状态.
解答 解:(1)①A量的增减,平衡不移动,说明A是固体,固体的物质的量不影响化学平衡,
故答案为:固或液;
②增大压强,平衡不移动,说明反应两边气体的体积相等,气体的化学计量数之和相等:当n=2时,A只能是非气体;当n=3时,A必须是气体,
故答案为:固或液;气;
③若A为固态,增大压强,C的组分含量减少,平衡向着逆向移动,逆向是体积减小的方向,所以n>2,故答案为:>2;
④温度升高,平衡向着吸热反应方向移动,所以正反应方向是吸热反应,该反应的逆反应是放热反应,故答案为:放;
(2)1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,则生成1mol水放出57.3kJ的热量,反应的热化学方程式为$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol,
故答案为:△H=-57.3 kJ/mol;$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-57.3kJ/mol;
(3)浓硫酸溶于水放热,醋酸为弱电解质,溶于水吸热,因反应热为负值,放出的热量越多,则△H越小,则△H3>△H2>△H1,
故答案为:△H3>△H2>△H1;
(4)已知①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H=-870.3kJ•mol-1,
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,
③2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488.3kJ•mol-1,
由盖斯定律可知,①-②×2+③得2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,所以H2燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ∕mol
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ∕mol.
点评 本题考查了影响化学平衡的因素,反应热的计算等问题,综合考查学生对基本概念的理解,为高考常见题型,难度不大.

| A. | Na2CO3(s) | B. | 3.0mol/LHNO3 | C. | CH3COONa(aq) | D. | CuSO4(aq) |
| A. | 肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 反应中电子可以在同种元素间转移 | |
| C. | 非金属单质在反应中只作氧化剂 | |
| D. | 金属原子失电子越多,其还原性越强 |
| A. | 1000 mL,106 gNa2CO3 | B. | 950 mL,101.8 g Na2CO3 | ||
| C. | 500 mL,286 g Na2CO3?10H2O | D. | 1000 mL,101.8 g Na2CO3 |
| A. | 2Na2O2+2N2O3═4NaNO2+O2 | B. | Na2O2+2NO2═2NaNO2+O2 | ||
| C. | Na2O2+N2O5═2 NaNO3+O2 | D. | 2Na2O2+2Mn2O7═4NaMnO4+O2 |
| A. | 白色沉淀是BaSO3 | B. | 白色沉淀是BaSO3和BaSO4的混合物 | ||
| C. | 白色沉淀是BaSO4 | D. | FeCl3已全部被氧化为FeCl2 |
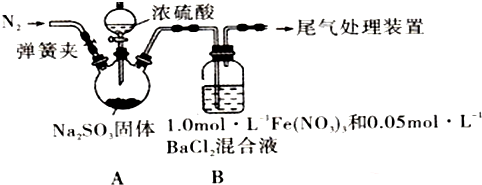
已知:l.0mol•L-1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O.
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是关闭分液漏斗活塞,打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.
(3)装置B中产生了白色沉淀,其成分是BaS04,说明SO2具有还原性.
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO${\;}_{3}^{-}$反应;
猜想3:…
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色.
【得出结论】:猜想1成立.其结论正确吗?否(填是或否).
若不正确,理由是可能SO2过量,溶解的SO2也能使KMnO4溶液褪色(正确无需回答).
(5)乙同学设计实验验证猜想2,请帮他完成下表中内容(提示:NO${\;}_{3}^{-}$在不同条件下的还原产物较复杂,有时难以观察到气体产生.除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等.)
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ①用NaNO3和盐酸配成pH=1, C(NO3-)=3mol•L-1的溶液,并替换装置B中的Fe(NO3)3溶液. ②打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.再打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸. | 若装置B中有白色沉淀生成,猜想2成立.否则,猜想2不成立. |
| A. | 肯定不含I- | B. | 肯定不含Cu2+ | C. | 可能含有SO32- | D. | 肯定不含有NH4+ |
 .
.