题目内容
2.X、Y、Z、W四种元素在周期表中相对位置如表所示,已知:Y、Z质子数之和为21,下列说法中正确的是( )| X | Y | ||
| Z | W |
| A. | X、Y、Z、W四种元素均为非金属元素 | |
| B. | Y、W的最简单氢化物中,Y的沸点高 | |
| C. | X、Y、Z、W最高价氧化物均为共价化合物 | |
| D. | W元素的简单离子半径小于Z元素的简单离子半径 |
分析 Y、Z质子数之和为21,由元素在周期表中的位置可知,X、Y、Z、W应为二、三周期元素,设Y的质子数为x,则X的质子数为x-2,W的质子数为x+8,Z的质子数为x+5,根据Y、Z质子数之和为21可得:x+x+5=21,解得:x=8,可推出Y为O元素,则X为C元素;Z为铝元素,W为硫元素,据此解答.
A.Z为铝元素,铝属于金属元素;
B.水分子间存在氢键,水的沸点较高;
C.氧化铝为离子化合物;
D.离子的电子层越多,离子半径越大,硫离子比铝离子多1个电子层.
解答 解:Y、Z质子数之和为21,由元素在周期表中的位置可知,X、Y、Z、W应为二、三周期元素,设Y的质子数为x,则X的质子数为x-2,W的质子数为x+8,Z的质子数为x+5,根据Y、Z质子数之和为21可得:x+x+5=21,解得:x=8,可推出Y为O元素,则X为C元素;Z为铝元素,W为硫元素,
A.C、O、S为非金属元素,而Al为金属元素,故A错误;
B.硫化氢常温下为气体,水分子之间存在氢键,常温下为液体,沸点较高,故B正确;
C.铝的最高价氧化物为氧化铝,氧化铝为离子化合物,故C错误;
D.W为S元素,其离子为硫离子,Z元素为铝,铝离子核外电子层数为2,硫离子的含有3个电子层,则硫离子半径大于铝离子,故D错误;
故选B.
点评 本题考查元素周期表和元素周期律的综合应用,题目难度中等,根据X、W质子数之和为22确定在周期表中所处的周期是关键,注意熟练掌握元素周期表结构、元素周期律内容.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列说法不正确的是( )
| A. | 同种元素的质子数必定相同 | |
| B. | 元素的化学性质主要决定于原子的最外层电子数 | |
| C. | 原子核都是由质子和中子构成的 | |
| D. | 元素性质呈现周期性变化的根本原因是核外电子排布呈周期性变化 |
7.垃圾分类有利于资源回收利用.下列垃圾归类不合理的是( )
| A. | 废易拉罐--可回收物 | B. | 废塑料瓶--其他垃圾 | ||
| C. | 废荧光灯管--有害垃圾 | D. | 不可再生废纸--可燃垃圾 |
14.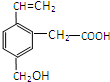 某有机物的结构如图所示,这种有机物不可能具有的性质是
某有机物的结构如图所示,这种有机物不可能具有的性质是
①能使酸性KMnO4溶液褪色;②可以燃烧;
③能发生水解反应;④能发生酯化反应;
⑤能发生加聚反应;⑥能跟NaOH溶液反应( )
 某有机物的结构如图所示,这种有机物不可能具有的性质是
某有机物的结构如图所示,这种有机物不可能具有的性质是①能使酸性KMnO4溶液褪色;②可以燃烧;
③能发生水解反应;④能发生酯化反应;
⑤能发生加聚反应;⑥能跟NaOH溶液反应( )
| A. | ①④ | B. | 只有⑥ | C. | 只有③ | D. | ④⑥ |
11.体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和,两者消耗NaOH的物质的量( )
| A. | 相同 | B. | 中和HCl的多 | C. | 中和CH3COOH的多 | D. | 无法比较 |
12.在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解,不同时刻测得生成O2的体积(已这算为标准状况)如下表.下列叙述不正确的是(溶液体积变化忽略不计)( )


| A. | 0-6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| B. | 6-10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) | |
| C. | 反应到6min时,H2O2分解了50% | |
| D. | 反应到6min时,c(H2O2)=0.30mol/L |
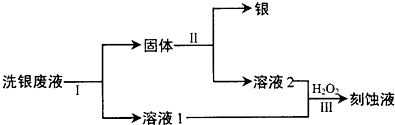
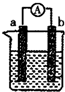 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.