题目内容
13.化学与科技、社会、环境密切相关,下列说法不符合科学原理的是( )| A. | 高纯硅制作光导纤维 | B. | 石墨制作火箭发动机喷管 | ||
| C. | 地沟油水解制取肥皂 | D. | 有机垃圾发酵生产沼气 |
分析 A.光导纤维主要成分是二氧化硅;
B.石墨及其制品具有耐高温、高强度的性质,具有高熔点,稳定,耐腐蚀的性能,具有良好的化学稳定性;
C.地沟油的成分是油脂;
D.沼气主要成分是甲烷,是有机物质在厌氧条件下,经过微生物的发酵作用而生成的一种混合气体.
解答 解:A.光导纤维主要成分是二氧化硅,不是硅,故A错误;
B.石墨及其制品具有耐高温、高强度的性质,具有高熔点,稳定,耐腐蚀的性能,具有良好的化学稳定性,制作火箭发动机喷管,故B正确;
C.地沟油的成分是油脂,在碱性条件下水解生成肥皂,故C正确;
D.沼气主要成分是甲烷,是有机物质在厌氧条件下,经过微生物的发酵作用而生成的一种混合气体,故D正确;
故选:A.
点评 本题考查了二氧化硅、石墨、地沟油等物质的用途,熟悉物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
4.下列说法中不正确的是( )
| A. | 在原电池中,物质在负极发生氧化反应 | |
| B. | 在原电池中,电子由负极流向正极 | |
| C. | 在电解池中,物质在阳极发生还原反应 | |
| D. | 在电解池中,与电源负极相连的电极是阴极 |
1.25℃时,甲溶液的pH是10,乙溶液的pH是11,甲溶液与乙溶液中c(H+)之比是( )
| A. | 1:2 | B. | 2:1 | C. | 1:10 | D. | 10:1 |
8.下列离子方程式书写不正确的是( )
| A. | FeO溶于稀硝酸:FeO+2H+═Fe2++H2O | |
| B. | 醋酸与碳酸钙反应:2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ | |
| C. | Ba(OH)2溶液与稀硫酸反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 往AlC13溶液中加入过量氨水:Al3++3 NH3•H2O═Al(OH)3↓+3NH4+ |
18.下列事实不能用勒夏特列原理解释的是( )
| A. | 配制氯化铁溶液时,加入少量稀盐酸 | |
| B. | 配制氯化亚铁溶液时,加入少量铁屑 | |
| C. | 在含有酚酞的氨水中加入少量NH4Cl,溶液颜色会变浅 | |
| D. | 在硫酸铜饱和溶液中加入一块胆矾,晶体外形变规则 |
5.下列化学反应的离子方程式不正确的是( )
| A. | Na2S溶液中加入少量FeCl3溶液:2Fe3++S2-→2Fe2++S↓ | |
| B. | 向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应:Ca2++2OH-+2HCO3-→CaCO3↓+2H2O+CO32- | |
| C. | 向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O→SO42-+Cl-+2H+ | |
| D. | Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: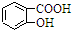 +CO32-→ +CO32-→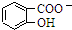 +HCO3- +HCO3- |
2.已知反应A(g)+B(g)?2C(g),B为有色气体,反应平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K=$\frac{[C]^{2}}{[A]•[B]}$,△H<0(填“<”、“>”、“=”).
(2)900℃时,向一个2L的密闭容器中充入2mol的A和8mol的B,如反应初始5s内A的平均反应速率ν(A)=0.1mol•L-1•s-1,则5s时c(C)=1mol•L-1 mol•L-1;若反应经一段时间后反应达到平衡,平衡时B的转化率为20%.
(3)一定温度下,若该反应在体积不变的密闭容器中发生,判断该反应是否达到平衡的依据为bc.
a.气体压强不随时间改变 b.单位时间里生成C和消耗C的量相等
c.气体颜色不随时间改变 d.气体平均摩尔质量不随时间改变
(4)在600℃下将1mol A和1molB加入如图1所示甲容器中,将4molC加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).保持温度和乙中压强不变,t2时刻向乙中再加入2mol He,达到新平衡后,则c(B)甲> c(B)乙(填“>”、“<”或“=”).图象2中能表示乙中反应速率变化情况的是A.
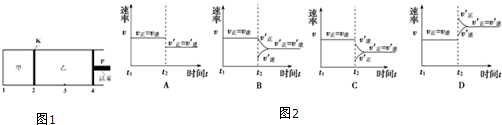
| 温度T (℃) | 600 | 800 | 900 | 1000 | 1200 |
| 平衡常数 K | 7.2 | 4.8 | 4.0 | 2.4 | 0.16 |
(1)该反应的平衡常数表达式K=$\frac{[C]^{2}}{[A]•[B]}$,△H<0(填“<”、“>”、“=”).
(2)900℃时,向一个2L的密闭容器中充入2mol的A和8mol的B,如反应初始5s内A的平均反应速率ν(A)=0.1mol•L-1•s-1,则5s时c(C)=1mol•L-1 mol•L-1;若反应经一段时间后反应达到平衡,平衡时B的转化率为20%.
(3)一定温度下,若该反应在体积不变的密闭容器中发生,判断该反应是否达到平衡的依据为bc.
a.气体压强不随时间改变 b.单位时间里生成C和消耗C的量相等
c.气体颜色不随时间改变 d.气体平均摩尔质量不随时间改变
(4)在600℃下将1mol A和1molB加入如图1所示甲容器中,将4molC加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).保持温度和乙中压强不变,t2时刻向乙中再加入2mol He,达到新平衡后,则c(B)甲> c(B)乙(填“>”、“<”或“=”).图象2中能表示乙中反应速率变化情况的是A.

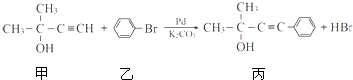
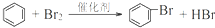 .
.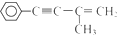 的反应条件是浓硫酸、加热.
的反应条件是浓硫酸、加热.