题目内容
12.某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.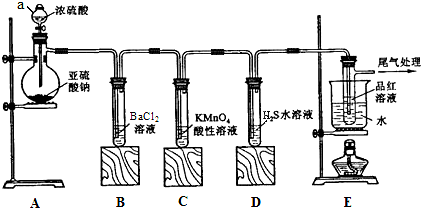
请回答下列问题:
①装置A中仪器a的名称是分液漏斗.蒸馏烧瓶中盛放亚硫酸钠,滴加浓硫酸反应产生二氧化硫,该反应的化学方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
②实验过程中,装置C中发生的现象是溶液由紫红色变为无色,说明SO2具有还原性;装置D中发生的现象是无色溶液中出现淡黄色浑浊,说明SO2具有氧化性;
③装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,无色溶液恢复为红色;
④实验室可采用NaOH溶液吸收处理尾气.
⑤实验一段时间后BaCl2溶液中仍然没有明显现象,这时将其分成两份,分别滴入氯水和氨水,都有白色沉淀生成,这两种沉淀的化学式依次是BaSO4和BaSO3.
分析 ①根据化学常用仪器及仪器的名称来分析;制备二氧化硫的方法是利用亚硫酸钠和浓硫酸反应生成;
②利用二氧化硫与高锰酸钾溶液,二氧化硫与硫化钠的氧化还原反应来分析反应现象和性质;
③根据二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色来解答;
④利用二氧化硫的性质来分析尾气处理,利用发生的化学反应来书写吸收尾气的离子反应;
⑤通入氯气后,二氧化硫被氧化成硫酸,硫酸与钡离子反应生成硫酸钡;通入氨气后,二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵与钡离子反应生成亚硫酸钡沉淀.
解答 解:①装置A中仪器a为分液漏斗;利用亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
故答案为:分液漏斗;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)高锰酸钾溶液为紫红色,具有氧化性,二氧化硫具有还原性,二者发生氧化还原反应,则观察到红色逐渐变浅直至完全褪去,二氧化硫进入硫化钠溶液中发生的氧化还原反应为2S2-+SO2+2H2O=3S↓+4OH-,则观察到出现黄色浑浊,B中S元素的化合价升高,表现还原性,C中二氧化硫中硫元素的化合价降低,表现氧化性,
故答案为:溶液由紫红色变为无色;还原;无色溶液中出现淡黄色浑浊;氧化;
③因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,则操作为待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,观察到的现象为无色溶液恢复为红色,
故答案为:待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,无色溶液恢复为红色;
④利用氢氧化钠溶液来吸收尾气,发生的离子反应为:SO2+2OH-=SO32-+H2O,
故答案为:NaOH;
⑤氯化钡不与二氧化硫反应,但通入氯气后,二氧化硫被氧化成硫酸,硫酸与钡离子反应生成白色沉淀BaSO4;通入氨气后,二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵与钡离子反应生成BaSO3沉淀,
故答案为:BaSO4;BaSO3.
点评 本题考查了二氧化硫的制取及二氧化硫的性质实验,题目难度中等,明确反应原理、二氧化硫的性质是解答本题的关键,注意掌握二氧化硫的性质及性质实验方案设计方法,试题培养了学生的分析能力及化学实验能力.

| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子数是次外层电子数的2倍 |
| X | L层有三个未成对电子 |
| Y | L层p电子数比s电子数多两个 |
| Z | 元素的最高正价为+7价 |
| A. | z离子的结构示意图为: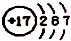 | B. | 分子TY2的键角为l80° | ||
| C. | X原子的轨道式为: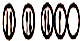 | D. | XZ3为非极性分子 |
| A. | 反应物化学性质 | B. | 温度 | C. | 反应物浓度 | D. | 催化剂 |
| A. | ①②④ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
| A. | 它位于元素周期表第二周期第ⅡA族 | B. | 硼酸是弱酸 | ||
| C. | 硼的金属性比铝强 | D. | 硼的原子半径比碳小 |
| A. | 在原电池中,物质在负极发生氧化反应 | |
| B. | 在原电池中,电子由负极流向正极 | |
| C. | 在电解池中,物质在阳极发生还原反应 | |
| D. | 在电解池中,与电源负极相连的电极是阴极 |
| A. | 1:2 | B. | 2:1 | C. | 1:10 | D. | 10:1 |
| 温度T (℃) | 600 | 800 | 900 | 1000 | 1200 |
| 平衡常数 K | 7.2 | 4.8 | 4.0 | 2.4 | 0.16 |
(1)该反应的平衡常数表达式K=$\frac{[C]^{2}}{[A]•[B]}$,△H<0(填“<”、“>”、“=”).
(2)900℃时,向一个2L的密闭容器中充入2mol的A和8mol的B,如反应初始5s内A的平均反应速率ν(A)=0.1mol•L-1•s-1,则5s时c(C)=1mol•L-1 mol•L-1;若反应经一段时间后反应达到平衡,平衡时B的转化率为20%.
(3)一定温度下,若该反应在体积不变的密闭容器中发生,判断该反应是否达到平衡的依据为bc.
a.气体压强不随时间改变 b.单位时间里生成C和消耗C的量相等
c.气体颜色不随时间改变 d.气体平均摩尔质量不随时间改变
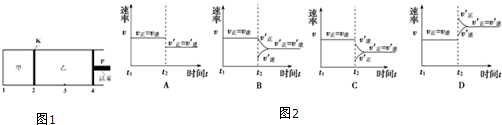
(4)在600℃下将1mol A和1molB加入如图1所示甲容器中,将4molC加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).保持温度和乙中压强不变,t2时刻向乙中再加入2mol He,达到新平衡后,则c(B)甲> c(B)乙(填“>”、“<”或“=”).图象2中能表示乙中反应速率变化情况的是A.
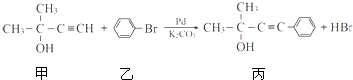
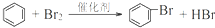 .
.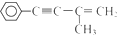 的反应条件是浓硫酸、加热.
的反应条件是浓硫酸、加热.