题目内容
4.下列能体现H2SO4中硫元素的氧化性的实验是( )| A. | 锌和稀硫酸反应 | B. | 稀硫酸滴入紫色石蕊试液 | ||
| C. | 浓硫酸用作干燥剂 | D. | 浓硫酸与铜在加热的条件下反应 |
分析 能体现H2SO4中硫元素的氧化性,则反应中硫元素化合价降低,据此判断.
解答 解:A.锌和稀硫酸反应生成硫酸锌与氢气,硫元素化合价不变,故A不选;
B.稀硫酸滴入紫色石蕊试液,溶液变红是因为硫酸电离产生氢离子,显酸性,硫元素化合价不变,故B不选;
C.浓硫酸具有吸水性,能够做干燥剂,硫元素化合价不变,故C不选;
D.浓硫酸与铜在加热的条件下反应生成硫酸铜、二氧化硫和水,硫元素化合价部分降低,体现浓硫酸的酸性和氧化性,故D选;
故选:D.
点评 本题考查了浓硫酸的性质,熟悉浓硫酸的强氧化性是解题关键,注意从元素化合价变化角度考虑.

练习册系列答案
相关题目
14.下列有关pH试纸的描述正确的是( )
| A. | 用pH试纸测定溶液的pH之前,要先用蒸馏水湿润 | |
| B. | 若用水湿润过的pH试纸去测定盐酸的pH,结果偏小 | |
| C. | 若用水湿润过的pH试纸去测定氢氧化钠溶液的pH,结果偏小 | |
| D. | 新制氯水呈酸性,所以只能使pH试纸变红 |
15.下列措施不能加快盐酸与块状碳酸钙反应速率的是( )
| A. | 改用粉末状碳酸钙 | B. | 滴入适量浓盐酸 | ||
| C. | 加入氯化钠固体 | D. | 升高温度 |
12.物质的鉴别方法多种多样.下列物质鉴别方法不能达到目的是( )
| A. | 用水鉴别乙醇、苯、溴苯 | |
| B. | 用Ba(OH)2溶液鉴别硫酸钠和亚硫酸钠 | |
| C. | 用溴水鉴别甲烷和乙烯 | |
| D. | 通过烧焦时的特殊气味鉴别纯毛和纯棉 |
19.下列有关能量转换的说法错误的是( )
| A. | 天然气燃烧是化学能转化为热能的过程 | |
| B. | 二次电池充电的过程是电能转化为化学能的过程 | |
| C. | 燃煤发电是从煤中的化学能经过一系列能量转换最终转化为电能的过程 | |
| D. | 植物通过光合作用将CO2转化为葡萄糖是太阳能转变为热能的过程 |
9.下列气体在水中溶解度最大的是( )
| A. | NO | B. | SO2 | C. | CO2 | D. | Cl2 |
13.对于如图所示的锌、铜和稀硫酸组成的原电池,下列说法正确的是( )
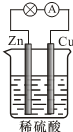

| A. | 负极的反应式为2H++2e-═H2↑ | |
| B. | 电子由Zn经外电路流向Cu,再经硫酸溶液流回Zn | |
| C. | 反应一段时间后,溶液的酸性增强 | |
| D. | 硫酸既提供反应物,又起导电作用 |
14.根据下列各反应现象所归纳的元素性质不正确的是( )
| A. | 将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出.不能说明钠的金属性比铜弱 | |
| B. | 用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝.说明氯元素的非金属性比碘元素强 | |
| C. | 把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出.说明Cl的非金属性比S强 | |
| D. | 将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,除共同产生H2外,还分别生成了NaCl、MgCl2、AlCl3,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol.说明这三种金属的活泼性为:Al>Mg>Na |