题目内容
3.用轨道表示式表示下列原子的价电子排布.(1)N
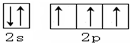 (2)Cl
(2)Cl .
.
分析 (1)N原子的最外层5个电子,为2s22p3,为2s和2p电子,且2p轨道中应为3个单电子;
(2)Cl原子的最外层7个电子,为3s22p5,为3s和3p电子,且3p轨道中应为5个电子,1个单电子.
解答 解:根据洪特规则可知,电子排布时优先占据1个轨道,且自旋方向相同,
(1)N原子的最外层5个电子,为2s22p3,为2s和2p电子,且2p轨道中应为3个单电子,价电子轨道排布式为: ,
,
故答案为: ;
;
(2)Cl原子的最外层7个电子,为3s23p5,为3s和3p电子,且3p轨道中应为5个电子,1个单电子,其轨道排布式为: ,
,
故答案为: .
.
点评 本题考查原子核外电子排布,明确价电子是解答本题的关键,注意洪特规则的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.金属锌(Zn)形成金属晶体,其金属原子堆积属于下列( )模式.
| A. | 简单立方 | B. | 钾型 | C. | 镁型 | D. | 铜型 |
14.下列有关pH试纸的描述正确的是( )
| A. | 用pH试纸测定溶液的pH之前,要先用蒸馏水湿润 | |
| B. | 若用水湿润过的pH试纸去测定盐酸的pH,结果偏小 | |
| C. | 若用水湿润过的pH试纸去测定氢氧化钠溶液的pH,结果偏小 | |
| D. | 新制氯水呈酸性,所以只能使pH试纸变红 |
11.下列物质中,可以形成酸雨的是( )
| A. | 甲烷 | B. | 氟氯代烃 | C. | 二氧化碳 | D. | 二氧化硫 |
18.下列各组物质互为同分异构体的是( )
| A. | H2O与D2O | B. | 35Cl与37Cl | ||
| C. | O2与O3 | D. | 乙醇与二甲醚(CH3-O-CH3) |
8.下列叙述正确的是( )
| A. | H2S、H2O、HF的稳定性依次减弱 | B. | RbOH、KOH、Mg(OH)2的碱性依次增强 | ||
| C. | Na+、Mg2+、Al3+的氧化性依次减弱 | D. | H2SiO3、H2CO3、H2SO4酸性依次增强 |
15.下列措施不能加快盐酸与块状碳酸钙反应速率的是( )
| A. | 改用粉末状碳酸钙 | B. | 滴入适量浓盐酸 | ||
| C. | 加入氯化钠固体 | D. | 升高温度 |
12.物质的鉴别方法多种多样.下列物质鉴别方法不能达到目的是( )
| A. | 用水鉴别乙醇、苯、溴苯 | |
| B. | 用Ba(OH)2溶液鉴别硫酸钠和亚硫酸钠 | |
| C. | 用溴水鉴别甲烷和乙烯 | |
| D. | 通过烧焦时的特殊气味鉴别纯毛和纯棉 |
13.对于如图所示的锌、铜和稀硫酸组成的原电池,下列说法正确的是( )
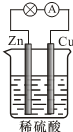

| A. | 负极的反应式为2H++2e-═H2↑ | |
| B. | 电子由Zn经外电路流向Cu,再经硫酸溶液流回Zn | |
| C. | 反应一段时间后,溶液的酸性增强 | |
| D. | 硫酸既提供反应物,又起导电作用 |