题目内容
7.在反应MnO2+4HCl(浓)$\frac{\underline{\;△\;}}{\;}$MnCl2+Cl2↑+2H2O中,若足量的MnO2参与反应,则反应后所得的溶液中,除MnCl2外还有HCl,剩余这种物质的原因是盐酸浓度降低,还原性减弱,不能被二氧化锰氧化.分析 随着反应的进行,盐酸的浓度逐渐降低,还原性减小,不能被二氧化锰氧化,则剩余,以此解答.
解答 解:反应中二氧化锰氧化HCl,但随着反应的进行,盐酸的浓度逐渐降低,还原性减小,不能被二氧化锰氧化,则反应后所得的溶液中,除MnCl2外还有HCl,
故答案为:HCl;盐酸浓度降低,还原性减弱,不能被二氧化锰氧化.
点评 本题考查氧化还原反应,为高频考点,侧重于二氧化锰与盐酸的反应,注意该反应的特点,难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
18.某盐的溶液中含有K+、Mg2+、NO3-、SO42-四种离子,若K+的浓度为0.2mol/L,Mg2+的浓度为0.4mol/L,SO42-的浓度为0.3mol/L,则NO3-的浓度为( )
| A. | 0.1mol/L | B. | 0.4mol/L | C. | 0.3mol/L | D. | 0.15mol/L |
2.下列说法中正确的是( )
| A. | 对有气体参加的化学反应,通过减小体积增大体系压强,可使单位体积内活化分子数增加,因而反应速率增大 | |
| B. | 升高温度,主要是因为分子运动加剧,碰撞频率提高,因而反应速率增大 | |
| C. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| D. | 加入适宜的催化剂,可使活化能增大,从而加快反应速率 |
5.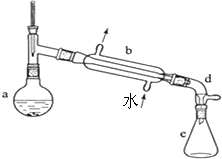 某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
相关数据如下:
实验步骤:
Ⅰ.[合成]:在a中加入20.00g纯环己醇及2小块沸石,冷却搅动下缓慢加入10mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
Ⅱ.[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得12.30g纯环己烯.
回答下列问题:
(1)装置b的名称是直形冷凝管.加入沸石的目的是防止混合液爆沸.
(2)本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(3)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4,加入无水CaCl2的作用是干燥所得环己烯(产物).
(4)本实验所得环己烯的产率是75%(产率=$\frac{实际产量}{理论产量}$×100%)
 某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
相关数据如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
Ⅰ.[合成]:在a中加入20.00g纯环己醇及2小块沸石,冷却搅动下缓慢加入10mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
Ⅱ.[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得12.30g纯环己烯.
回答下列问题:
(1)装置b的名称是直形冷凝管.加入沸石的目的是防止混合液爆沸.
(2)本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(3)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4,加入无水CaCl2的作用是干燥所得环己烯(产物).
(4)本实验所得环己烯的产率是75%(产率=$\frac{实际产量}{理论产量}$×100%)
2. 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用.
工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H1
下表所列数据是以上反应在不同温度下的化学平衡常数的数值:
(1)Ⅰ、在一密闭容器中发生反应并达到平衡后,保持其他条件不变,对容器升温,此反应的化学反应平衡应逆向移动(填“正向”、“逆向”、“不”)
Ⅱ、某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol/L,则CO的转化率为80%,此时的温度>250℃(填“>”、“<”、“=”)
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H1=-Q1kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-Q2 kJ/mol
③H2O(g)=H2O(l)△H3=-Q3 kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-(0.5Q1-0.5Q2-2Q3)kJ/mol
(3)某同学依据甲醇燃烧的反应原理,设计如右图所示的电池装置,工作一段时间后,测得溶液的pH将降低(填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:CH3OH-6e-+8OH-═CO32-+6H2O.
 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用.工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H1
下表所列数据是以上反应在不同温度下的化学平衡常数的数值:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
Ⅱ、某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol/L,则CO的转化率为80%,此时的温度>250℃(填“>”、“<”、“=”)
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H1=-Q1kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-Q2 kJ/mol
③H2O(g)=H2O(l)△H3=-Q3 kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-(0.5Q1-0.5Q2-2Q3)kJ/mol
(3)某同学依据甲醇燃烧的反应原理,设计如右图所示的电池装置,工作一段时间后,测得溶液的pH将降低(填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:CH3OH-6e-+8OH-═CO32-+6H2O.
3.室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 溶液中导电粒子的数目增加,导电性增强 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•(O{H}^{-})}$不变 |