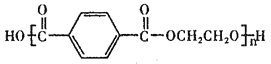
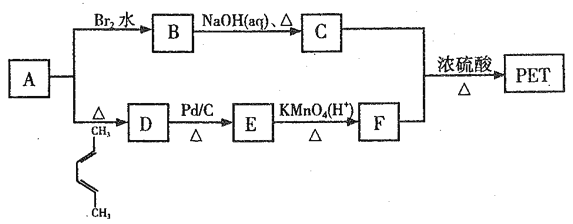
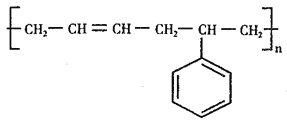
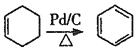题目内容
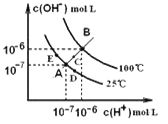
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
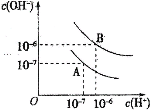
(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为______________。
(2)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________。
(3)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积不变,则a=_________,实验②所得溶液中由水电离产生的c(OH-)=______。
(4)95℃时,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·/span>L-1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.l mol·L-1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显_____(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后反应的化学方程式_______________________。所得溶液显______(填“酸”、“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为________(混合时,忽略溶液体积的变化)。
【答案】10:1 a+b=14(或pH1+pH2=14) 4 1.0×10-7 中 Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH 碱 11
【解析】
(1)25℃时,先算离子积常数,再表示出NaOH溶液的c(OH-)与H2SO4溶液的c(H +),混合后,根据混合溶液的pH=7建立方程式进行计算。
(2)95℃时,先算离子积常数,再表示100体积pH1=a的某强酸溶液的c(H +)与1体积pH2=b的某强碱溶液的c(OH-),混合后溶液呈中性,根据![]() 建立关系计算。
建立关系计算。
(3)根据序号①得出,Ba(OH)2溶液pH=8,再根据序号③得出的等体积混合后,呈中性得出a,实验②所得溶液中c(H+)和c(OH-),②中所得溶液是氯化钡和氢氧化钡的混合物,抑制水的电离,因此溶液中的氢离子浓度是水电离出的。
(4)①按丁方式混合后,氢离子物质的量和氢氧根物质的量相等;②按乙方式混合后反应是硫酸根和钡离子反应,氢离子和氢氧根反应,还剩余氢氧根;③按甲方式混合,根据过量进行计算。
(1)25℃时,离子积常数为1×10-14,将pH=9的NaOH溶液c(OH-)=1×10-5molL-1与pH=4的H2SO4溶液c(H+)=1×10-4molL-1混合,若所得混合溶液的pH=7,![]() ,得到
,得到![]() ,
,![]() ,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为10:1,故答案为:10:1。
,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为10:1,故答案为:10:1。
(2)95℃时,离子积常数为1×10-12,若100体积pH1=a的某强酸溶液c(H +)=1×10-amolL-1与1体积pH2=b的某强碱溶液c(OH-)=1×10b-12molL-1混合后溶液呈中性,![]() ,
,![]() ,a+b=14,pH1 + pH2=14,因此强酸的pH1与强碱的pH2之间应满足的关系是14,故答案为:14。
,a+b=14,pH1 + pH2=14,因此强酸的pH1与强碱的pH2之间应满足的关系是14,故答案为:14。
(3)根据序号①得出,Ba(OH)2溶液pH=8,根据序号③得出的等体积混合后,pH=6,溶液显中性,两者pH之和为12,则a=12–8=4,实验②所得溶液中c(H+)=1×10-7molL-1,则c(OH-)=1×10-5molL-1,②中所得溶液是氯化钡和氢氧化钡的混合物,抑制水的电离,因此溶液中的氢离子浓度是水电离出的,水电离出的氢离子等于水电离出的氢氧根离子,因此由水电离产生的c(OH-)=1×10-7molL-1,故答案为:4;1.0×10-7。
(4)①按丁方式混合后,氢离子物质的量和氢氧根物质的量相等,因此所得溶液显中性,故答案为:中。
②按乙方式混合后反应是硫酸根和钡离子反应,氢离子和氢氧根反应,还剩余氢氧根,因此化学方程式Ba(
③按甲方式混合,所得溶液![]() ,
,![]() ,因此pH为11,故答案为:11。
,因此pH为11,故答案为:11。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】我国是以煤炭为主要能源的发展中国家,煤炭燃烧产生的烟气中含有大量的NOx和SO2,带来了严重的大气污染。某化工小组进行了ClO2协同氨水法脱除模拟烟气中NOx和SO2的实验研究,其流程如图:
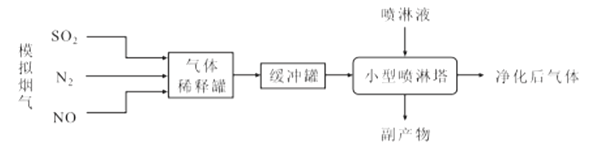
回答下列问题:
(1)制备“模拟烟气”时应首先向装置管道内通入__,目的是__。
(2)“喷淋液”中所含ClO2可通过向酸性氯酸钠溶液中加入葡萄糖的方法制备,同时产生CO2等物质,则该反应的离子方程式为__,还可将葡萄糖替换为__(填字母标号)。
A.FeCl3溶液 B.SO3 C.甲醇 D.酸性KMnO4溶液
(3)利用ClO2协同氨水进行脱硫脱硝净化时,污染性气体脱除效率变化情况如图所示,则该脱除技术的最佳温度应为__℃,喷淋塔中可能产生的一种副产物的化学式为__,该物质的常见用途是__。

(4)传统湿式氨法烟气处理技术以尿素[CO(NH2)2]热水解产生的NH3溶于水为喷淋液。在催化剂作用下,喷淋除去NO过程中有一种无污染气体生成,该反应的化学方程式为__。
(5)该化工小组设定模拟烟气流量am3/h,进口NO质量浓度bmg/m3,吸收液循环量cL/h,通过离子色谱测定脱除前后吸收液中主要离子浓度如下表所示,则NO的脱除率为__(用含有a、b、c的代数式表示)。
离子种类 浓度数据 | ClO2 (mg/L) | Cl- (mg/L) | SO42- (mg/L) | SO32- (mg/L) | NO3- (mg/L) | NO2- (mg/L) |
吸收前 | 150 | 43.54 | —— | —— | —— | —— |
吸收后 | 12.62 | 110.49 | 213.64 | —— | 62.00 | —— |
反应前后差值 | 137.38 | 66.95 | 213.64 | —— | 62.00 | —— |
注:“——”表示该离子低于检测极限,可以认为不存在。