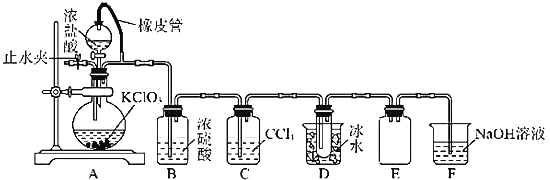
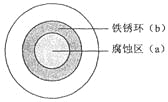
题目内容
【题目】研究苯酚与 FeCl3 溶液的显色反应,实验如下:
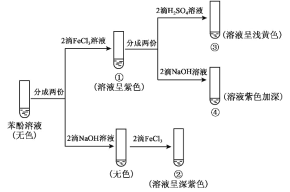
下列说法不正确的是( )
A.苯酚属于弱酸,电离方程式为![]()
![]() +H+
+H+
B.向试管②中滴加硫酸至过量,溶液颜色变为浅黄色
C.对比①③中的现象说明,滴加稀硫酸后,c(Fe3+)变小
D.对比①②、①④中的现象,说明紫色物质的生成与溶液中c(![]() )相关
)相关
【答案】C
【解析】
A.苯酚是一元弱酸,发生电离平衡:![]()
![]() +H+,故A正确;
+H+,故A正确;
B.试管②中是在碱性条件下发生了显色反应,向其中滴加硫酸至过量,相当于进行了①至③过程,溶液呈浅黄色,故B正确;
C.根据离子方程式:![]() ,滴加稀硫酸后,溶液从紫色变为黄色,c(Fe3+)变大,故C错误;
,滴加稀硫酸后,溶液从紫色变为黄色,c(Fe3+)变大,故C错误;
D.①②、①④实验中都加入了氢氧化钠,都生成了![]() , 紫色物质的生成与溶液中的c(
, 紫色物质的生成与溶液中的c(![]() )有关,故D正确;
)有关,故D正确;
答案选C。

【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
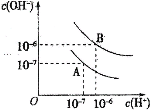
(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为______________。
(2)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________。
(3)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积不变,则a=_________,实验②所得溶液中由水电离产生的c(OH-)=______。
(4)95℃时,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·/span>L-1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.l mol·L-1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显_____(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后反应的化学方程式_______________________。所得溶液显______(填“酸”、“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为________(混合时,忽略溶液体积的变化)。