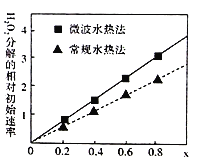
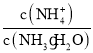题目内容
【题目】25℃时,H2SO3HSO3-+H+的电离常数Ka=1×10-2,则该温度下NaHSO3的水解平衡常数Kh=____________,若向NaHSO3溶液中加入少量的I2,则溶液中![]() 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。
【答案】1.0×10-12 增大
【解析】
依据水解常数与电离常数及Kw的关系计算水解常数,将![]() 转化为
转化为![]() ,变为一个变量进行判断。
,变为一个变量进行判断。
25℃时,H2SO3HSO3-+H+的电离常数Ka=1×10-2,HSO3-的水解方程式为HSO3-+H2OH2SO3+OH,则NaHSO3的水解平衡常数 ,当加入少量I2时,发生反应HSO3-+ I2 + H2O=3H+ + SO42- + 2I,溶液酸性增强,c(H+)增大,c(OH-)减小,但是温度不变,Kh不变,则
,当加入少量I2时,发生反应HSO3-+ I2 + H2O=3H+ + SO42- + 2I,溶液酸性增强,c(H+)增大,c(OH-)减小,但是温度不变,Kh不变,则![]() 增大,故答案为:1.0×10-12;增大。
增大,故答案为:1.0×10-12;增大。

 阅读快车系列答案
阅读快车系列答案【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:

(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为______________。
(2)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________。
(3)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积不变,则a=_________,实验②所得溶液中由水电离产生的c(OH-)=______。
(4)95℃时,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·/span>L-1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.l mol·L-1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显_____(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后反应的化学方程式_______________________。所得溶液显______(填“酸”、“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为________(混合时,忽略溶液体积的变化)。