题目内容
【题目】我国是以煤炭为主要能源的发展中国家,煤炭燃烧产生的烟气中含有大量的NOx和SO2,带来了严重的大气污染。某化工小组进行了ClO2协同氨水法脱除模拟烟气中NOx和SO2的实验研究,其流程如图:
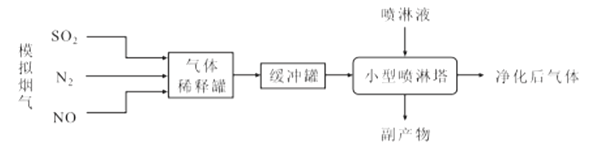
回答下列问题:
(1)制备“模拟烟气”时应首先向装置管道内通入__,目的是__。
(2)“喷淋液”中所含ClO2可通过向酸性氯酸钠溶液中加入葡萄糖的方法制备,同时产生CO2等物质,则该反应的离子方程式为__,还可将葡萄糖替换为__(填字母标号)。
A.FeCl3溶液 B.SO3 C.甲醇 D.酸性KMnO4溶液
(3)利用ClO2协同氨水进行脱硫脱硝净化时,污染性气体脱除效率变化情况如图所示,则该脱除技术的最佳温度应为__℃,喷淋塔中可能产生的一种副产物的化学式为__,该物质的常见用途是__。

(4)传统湿式氨法烟气处理技术以尿素[CO(NH2)2]热水解产生的NH3溶于水为喷淋液。在催化剂作用下,喷淋除去NO过程中有一种无污染气体生成,该反应的化学方程式为__。
(5)该化工小组设定模拟烟气流量am3/h,进口NO质量浓度bmg/m3,吸收液循环量cL/h,通过离子色谱测定脱除前后吸收液中主要离子浓度如下表所示,则NO的脱除率为__(用含有a、b、c的代数式表示)。
离子种类 浓度数据 | ClO2 (mg/L) | Cl- (mg/L) | SO42- (mg/L) | SO32- (mg/L) | NO3- (mg/L) | NO2- (mg/L) |
吸收前 | 150 | 43.54 | —— | —— | —— | —— |
吸收后 | 12.62 | 110.49 | 213.64 | —— | 62.00 | —— |
反应前后差值 | 137.38 | 66.95 | 213.64 | —— | 62.00 | —— |
注:“——”表示该离子低于检测极限,可以认为不存在。
【答案】N2 排尽装置中空气,防止NO被O2氧化 24ClO3-+C6H12O6+24H+=24ClO2↑+6CO2↑+18H2O C 40 NH4Cl或(NH4)2SO4或NH4NO3 作氮肥 4NH3+6NO![]() 5N2+6H2O
5N2+6H2O ![]() ×100%
×100%
【解析】
(1)模拟烟气中含有一氧化氮,易被空气中的氧气氧化;
(2)根据题意信息,结合物料守恒书写反应方程式,反应中葡萄糖做还原剂;
(3)根据图示分析,脱除效率最高点对应的温度为最佳温度;ClO2、NOx和SO2可与氨水反应生成相应的铵盐,结合铵盐在生活中的作用分析;
(4)氨气、一氧化氮,两者在催化剂的作用下反应,生成一种无污染的气体,由元素守恒可推知,生成物为氮气和水;
(5) 该化工小组设定模拟烟气流量am3/h,进口NO质量浓度bmg/m3,可计算出每小时通入的烟气中含NO的质量,根据表格数据显示,NO被转化为NO3-,根据氮原子守恒可计算出每小时被转化的NO的质量,进而计算出NO的脱除率。
(1)模拟烟气中含有一氧化氮,易被空气中的氧气氧化,制备“模拟烟气”时应首先向装置管道内通入N2,排尽装置中空气,防止NO被O2氧化;
(2) “喷淋液”中所含ClO2可通过向酸性氯酸钠溶液中加入葡萄糖的方法制备,同时产生CO2等物质,则该反应的离子方程式为:24ClO3-+C6H12O6+24H+=24ClO2↑+6CO2↑+18H2O;该反应中葡萄糖做还原剂,FeCl3溶液、SO3、.酸性KMnO4溶液均为氧化剂,只有C甲醇具有还原性,答案选C;
(3)根据图示分析,脱除效率最高点对应的温度为最佳温度,脱除效率最佳温度为40℃,ClO2具有氧化性,一定条件下可与NOx、SO2发生氧化还原反应生成硫酸、硝酸和盐酸,再与氨水反应生成硝酸铵、硫酸铵、氯化铵,铵盐在生产生活中常用作氮肥;
(4)由题意可知,传统湿式氨法烟气处理技术的反应物为氨气、一氧化氮,两者在催化剂的作用下反应,生成一种无污染的气体,由元素守恒可推知,生成物为氮气和水,配平后化学方程式为:4NH3+6NO![]() 5N2+6H2O;
5N2+6H2O;
(5)该化工小组设定模拟烟气流量am3/h,进口NO质量浓度bmg/m3,则每小时通入的模拟烟气中NO的质量am3/h×bmg/m3×1h=abmg,根据表格数据显示,NO被转化为NO3-,每小时生成的硝酸根的质量为62.00mg/L×cL/h×1h= 62cmg,根据氮原子守恒,一氧化氮与硝酸根离子的关系式为NO~ NO3-,则当每小时有62cmg硝酸根生成时,吸收一氧化氮的质量为30cmg,故NO的脱除率=![]() ×100%=
×100%=![]() ×100%=
×100%= ![]() ×100%。
×100%。

【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
(实验Ⅰ)制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
制备装置如图所示(夹持装置略去):
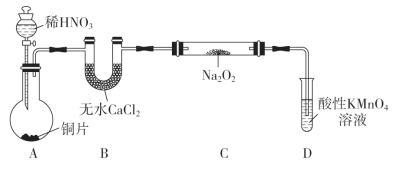
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为____________。
(2)如果没有B装置,C中发生的副反应有_____________、____________。
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。于是进行了适当的改进,改进后提高了NaNO2的纯度,则其改进措施是________________________________。
(实验Ⅱ)测定制取的样品中NaNO2的含量
步骤:
a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:
试管编号 | ① | ② | ③ | ④ | ⑤ |
NaNO2含量/(mg·L-1) | 0 | 20 | 40 | 60 | 80 |
b.称量0.10 g制得的样品,溶于水配成500 mL溶液。取5 mL待测液,加入1 mL M溶液,再加蒸馏水至10 mL并振荡,与标准色阶比较。
(4)步骤b中比较结果是:待测液颜色与③标准色阶相同,则甲同学制得的样品中NaNO2的质量分数是________。
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。
实验方案 | 实验现象 | 实验结论 |
取5 mL待测液,加入______________,振荡,再加入1 mL M溶液,_______________,再振荡,与③标准色阶对比 | _______________ | 维生素C可以有效降低NaNO2的含量 |
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
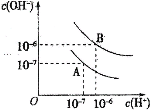
(1)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则pH=9的NaOH溶液与pH=4的H2SO4溶液的体积之比为______________。
(2)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________。
(3)95℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积不变,则a=_________,实验②所得溶液中由水电离产生的c(OH-)=______。
(4)95℃时,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·/span>L-1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.l mol·L-1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显_____(填“酸”、“碱”或“中”)性。
②写出按乙方式混合后反应的化学方程式_______________________。所得溶液显______(填“酸”、“碱”或“中”)性。
③按甲方式混合,所得溶液的pH为________(混合时,忽略溶液体积的变化)。