题目内容
10.有一种pH=12的NA.OH 溶液100mL,要使它的pH值降到11:(1)如果加入蒸馏水,应加900mL.﹙不考虑溶液体积效应,下同﹚
(2)如果加入pH=10的NaOH 溶液,应加1000mL.
(3)如果加入0.1mol•L-1的盐酸,应加8.91mL.
分析 (1)先根据溶液的pH计算氢氧根离子浓度,再根据c1V1=c2(V1+V2)计算加入的水体积;
(2)先根据溶液的pH计算氢氧根离子浓度,再根据c1V1+c2V2=c3(V1+V2)计算加入的氢氧化钠溶液体积;
(3)先计算混合溶液中氢氧根离子浓度,再根据c(OH-)=$\frac{n(碱)-n(酸)}{V(酸)+V(碱)}$计算.
解答 解:(1)pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V2,c1V1=c2(V1+V2)=0.01mol/L×0.1L=(0.1+V2)L,V2=$\frac{0.01mol/L×0.1L}{0.001mol/L}$=0.9L=900mL,
故答案为:900;
(2)pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L,设加入pH=10的NaOH溶液体积是V2,
c1V1+c2V2=c3(V1+V2)=0.01mol/L×0.1L+0.0001mol/L×V2=0.001mol/L(0.1+V2),
V2=1L=1000mL,
故答案为:1000;
(3)0.1mol/L的HCl溶液中氢离子浓度是0.1mol/L,设加入盐酸的体积是V,
c(OH-)=$\frac{n(碱)-n(酸)}{V(酸)+V(碱)}$=$\frac{0.01mol/L×0.1L-0.1mol.L×VL}{(0.1+V)L}$=0.001mol/L,
解得:V=8.91mL,
故答案为:8.91.
点评 本题考查了溶液pH的计算,题目难度中等,明确酸碱混合的定性判断方法及溶液pH的表达式为解答关键,注意掌握溶液pH的简单计算方法,试题侧重考查学生的分析能力及化学计算能力.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | 甲烷化学性质比较稳定,不能被任何氧化剂氧化 | |
| B. | 乙烯和苯分子中各原子都在同一平面 | |
| C. | 乙烯和苯均可使溴水褪色,且其褪色原理相同 | |
| D. | 石油的裂化、分馏、裂解,煤的干馏都是化学变化 |
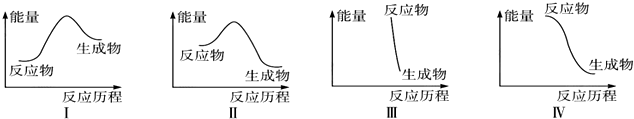
| A. | Ⅰ可表示放热反应 | B. | Ⅱ可表示放热反应 | ||
| C. | Ⅲ可表示爆炸反应 | D. | Ⅳ可表示醋酸和碱的中和反应 |
| A. | HOOC-COOH | B. | HO(CH2)2COOH | C. | CH2OHCHOHCOOH | D. | (CH3)3CCOOH |
| A. | 2.0 | B. | 12.3 | C. | 1.7 | D. | 12.0 |
| A. | 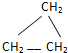 | B. | 乙烷 | C. | 甲烷 | D. | CH3CH=CH2 |
| A. | H2O | B. | 溴水 | ||
| C. | 新制Cu(OH)2 | D. | 酸性高锰酸钾溶液 |
| A. | 做菜时用适量的食盐、味精和醋调味 | |
| B. | 把三聚氰胺添加到牛奶中 | |
| C. | 把发霉的大米淘净后做饭 | |
| D. | 把色彩鲜艳的着色剂添加到婴儿食品中 |
