题目内容
15.氮元素是地球大气中含量最多的元素.(1)氮元素和碳元素一样也存在一系列氢化物并有广泛应用.例如:NH3、N2H4、N3H5、N4H6….
①写出该系列氢化物的通式:NnHn+2(n≥2).
②N4H5Cl的同分异构体有3 种.
(2)NH3、OH-、H2O结合质子(H+)的能力由强到弱的顺序是OH->NH3>H2O,其理由用两个反应的离子方程式表示为NH4++OH-=NH3+H2O和NH3+H3O+=NH4++H2O.
(3)在碱性介质中,用N2H4与NO2可组合制成燃料电池,产物中无污染物,试写出该电池正极的电极反应式4H2O+2NO2+8e-=N2+8OH-.
(4)①CaCO3和适量稀HNO3溶液反应时,每产生4.4g气体(不考虑气体溶解),放热akJ,则该反应的热化学方程式为CaCO3(s)+2HNO3(aq)=Ca(NO3)2(aq)+H2O(l)+CO2(g)△H=-10a kJ/mol
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示.

请用离子方程式表示B-C段发生的反应:Ca2++CO32-=CaCO3↓.
分析 (1)①根据氮原子和氢原子个数之间的关系确定氢化物的通式;
②N4H6的同分异构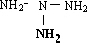 分子中氢原子相同、NH2-NH-NH-NH2,分子中两种氢原子,一氯代物有三种结构说明有机物中含有三种类型的氢原子;
分子中氢原子相同、NH2-NH-NH-NH2,分子中两种氢原子,一氯代物有三种结构说明有机物中含有三种类型的氢原子;
(2)对应的碱越强,则得到质子的能力越强;
(3)用N2H4与NO2可组合制成燃料电池,产物中无污染物,即为氮气和水,原电池的正极上发生得电子的还原反应;
(4)①每产生4.4g 气体(不考虑气体溶解),放热a kJ,每产生44g 气体(不考虑气体溶解),放热10a kJ;
②上述反应至无气泡逸出后,取适量残留溶液,含氯化钙,逐滴滴入碳酸钠溶液,由B-C段pH=7,可知反应生成碳酸钙沉淀和NaCl.
解答 解:(1)①根据氮原子和氢原子个数之间的关系:氢原子个数比氮原子个数多2,所以通式表示为:NnHn+2(n≥2),故答案为:NnHn+2(n≥2);
②依据氮原子连接方式不同得到不同的结构,N4H6的同分异构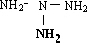 分子中氢原子相同、NH2-NH-NH-NH2,分子中两种氢原子,则N4H5Cl的同分异构体有3种
分子中氢原子相同、NH2-NH-NH-NH2,分子中两种氢原子,则N4H5Cl的同分异构体有3种
故答案为:3;
(2)微粒在溶液中的碱性为:OH->NH3>H2O,则碱性越强得到质子的能力越强,则结合质子能力:OH->NH3>H2O,理由用两个反应的离子方程式表示为NH4++OH-=NH3+H2O,NH3+H3O+=NH4++H2O,
故答案为:OH->NH3>H2O,NH3+H3O+=NH4++H2O;
(3)用N2H4与NO2可组合制成燃料电池,产物中无污染物,即为氮气和水,二氧化氮中氮元素化合价降低,在原电池的正极上时二氧化氮发生得电子的还原反应:4H2O+2NO2+8e-=N2+8OH-,故答案为:4H2O+2NO2+8e-=N2+8OH-;
(4)①每产生4.4g 气体(不考虑气体溶解),放热a kJ,每产生44g 气体(不考虑气体溶解),放热10a kJ,热化学方程式为:CaCO3(s)+2HNO3(aq)=Ca(NO3)2(aq)+H2O(l)+CO2(g)△H=-10a kJ/mol
故答案为:CaCO3(s)+2HNO3(aq)=Ca(NO3)2(aq)+H2O(l)+CO2(g)△H=-10a kJ/mol;
②上述反应至无气泡逸出后,取适量残留溶液,含氯化钙,逐滴滴入碳酸钠溶液,由B-C段pH=7,可知反应生成碳酸钙沉淀和NaCl,离子反应为Ca2++CO32-=CaCO3↓,故答案为:Ca2++CO32-=CaCO3↓.
点评 本题考查较综合,涉及元素周期表的结构及应用、结合质子能力的比较及应用、原电池原理分析、离子反应及图象分析等,注重高频考点的考查,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | ③④⑤⑦ | B. | ③④⑦ | C. | ④⑦ | D. | ④⑥⑦ |
| A. | 硫黄 | B. | 硫酸钠 | C. | 酒精 | D. | 硝酸钾溶液 |
| A. | 尼古丁 | B. | CO2 | C. | H2S | D. | NH3 |
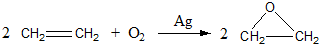
 ;反应类型:加聚反应.
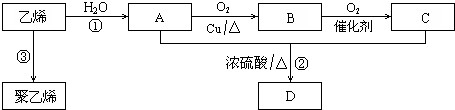
;反应类型:加聚反应.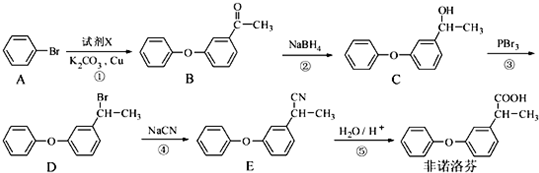
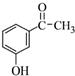 .
.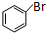 +2NaOH$\stackrel{一定条件}{→}$
+2NaOH$\stackrel{一定条件}{→}$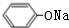 +NaBr+H2O.
+NaBr+H2O.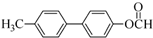 .
.