题目内容
5.等体积混合0.1mol•L-1的盐酸和0.06mol•L-1的Ba(OH )2溶液,不考虑体积效应,即认为混合溶液的体积等于进行混合的两溶液体积之和,溶液的pH值等于( )| A. | 2.0 | B. | 12.3 | C. | 1.7 | D. | 12.0 |
分析 计算出氢离子、氢氧根离子浓度,然后根据等体积混合后酸碱过量情况及水的离子积计算出反应后的溶液中氢离子浓度,最后计算出溶液的pH.
解答 解:0.1mol•L-1盐酸溶液中氢离子浓度为0.1mol/L,
0.06mol•L-1氢氧化钡溶液中氢氧根离子浓度为:0.12mol/L,两溶液等体积混合后氢氧根离子过量,
设溶液体积为VL,则反应后溶液中氢氧根离子浓度为:$\frac{0.12mol/L×VL-0.1mol/L×VL}{2V}$=0.01mol/L,
溶液中氢离子浓度C(H+)=$\frac{1×1{0}^{-14}}{0.01}$mol/L=1×10-12mol/L,
则反应后溶液的pH=-lgc(H+)=12.0,
故选D.
点评 本题考查了酸碱混合后溶液pH的计算,题目难度中等,明确判断酸碱混合的定性判断及pH的计算方法为解答关键,注意掌握溶液pH的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
16.由于某一条件的改变容器的平衡3A(g)+B(g)?2C(g)△H<0,向正反应方向发生了移动.新的平衡状态与原平衡状态相比,下列判断中不正确的是( )
①容器内的温度一定升高
②v正一定变大
③容器中C物质的浓度一定升高
④容器内的压强一定降低.
①容器内的温度一定升高
②v正一定变大
③容器中C物质的浓度一定升高
④容器内的压强一定降低.
| A. | ①④ | B. | ①③ | C. | ②③④ | D. | ①②③④ |
13.研制和开发不含碳并可工业生产的清洁能源,一直是科学家不懈追求的目标.目前液氨被人们视为一种潜在的清洁燃料.液氨燃烧的化学反应方程式为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.和氢燃料相比有关数据见下表,据此判断正确的是( )
①以氨和氢为燃料时,均可以减缓温室效应
②氨泄漏到空气中比氢气更易发生爆炸
③等质量的氨和氢分别燃烧,氨放出的热量多
④氨的液化比氢容易得多.
| 燃料 | 沸点/℃ | 燃烧热/(kJ•mol-1) | 相对分子质量/(g•mol-1) | 液态密度/(g•cm-3) |
| 氢 | -252.60 | 238.40 | 2.02 | 0.07 |
| 氨 | -33.50 | 317.10 | 17.03 | 0.61 |
②氨泄漏到空气中比氢气更易发生爆炸
③等质量的氨和氢分别燃烧,氨放出的热量多
④氨的液化比氢容易得多.
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
20.NA代表阿伏加德罗常数,有关说法正确的是( )
| A. | 常温常压下,11.2L乙烯所含分子数目小于0.5NA | |
| B. | 常温常压下,28g乙烯和丙烯的混合气体中所含碳原子数目小于NA | |
| C. | 乙炔的摩尔质量为26g | |
| D. | 标准状态下,将22.4L乙醇溶于水后配成500mL溶液,所得溶液物质的量浓度为2 mol/L |
17.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | CO2 | B. | BF3 | C. | PCl5 | D. | HCl |
14.下列各有机物在一定的条件下能发生消去反应的是( )
| A. | CH3Cl | B. | (CH3)3CCH2OH | C. | (CH3)3CCl | D. | 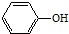 |