题目内容
2.金属钦及钛的合金被认为是21世纪重要的金属材料.常温下钛不和非金属、强酸反应.以钛铁矿【主要成分为FeTi03(钛酸亚铁,不溶于水)、Fe203及少量SiO2杂质」为主要原料冶炼金属饮的主要工艺过程如图: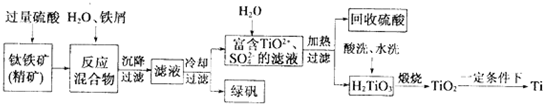
回答下列问题:
(1)绿矾的化学式是FeSO4•7H2O
(2)FeTi03与过量硫酸反应的离子方程式为FeTiO3+4H+=Fe2++TiO2++2H2O
(3)取少量酸洗后的H2Ti03,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2Ti03中存在的杂质离子是Fe2+.这种H2Ti03即使用水充分洗涤,缎烧后获得的TiO2也会发黄,发黄的杂质是Fe2O3(填化学式).
(4)以TiO2为原料制取金属钛的其中一步反应为Ti02.氯气和焦炭反应生成TiCl4,己知该反应中氧化剂与还原剂的物质的量之比为1:1,则另一生成物为CO.
(5)用Mg还原TiCl4制金属钛取过程中必须在1 070K的温度下进行,你认为还应该控制的反应条件是隔绝空气(或惰性气氛中);所得到的金属钛中混有少量杂质,可加入稀盐酸或稀硫酸溶解后除去.
分析 含有Fe2O3、SiO2的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)加硫酸,溶解,过滤,滤液中含有FeSO4(aq)、TiOSO4(aq)和Fe2(SO4)3(aq),加铁粉,把三价铁离子还原为亚铁离子,降温结晶过滤,得到绿矾即硫酸亚铁晶体,滤液为TiOSO4(aq),滤液加热,使TiOSO4水解生成H2TiO3固体,洗涤、干燥、煅烧得到TiO2,在一定条件下,将TiO2还原生成Ti,据此分析解答.
(1)绿矾即硫酸亚铁晶体;
(2)FeTi03与过量硫酸反应生成TiOSO4,FeSO4和H2O;
(3)根据亚铁离子的检验操作和现象分析;根据Fe2O3的颜色分析;
(4)反应中Ti元素化合价未变化,氯元素化合价由0价降低为-1价,根据电子转移守恒计算碳元素在产物中化合价,据此结合元素守恒判断;
解答 解:含有Fe2O3、SiO2的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)加硫酸,溶解,过滤,滤液中含有FeSO4(aq)、TiOSO4(aq)和Fe2(SO4)3(aq),加铁粉,把三价铁离子还原为亚铁离子,降温结晶过滤,得到绿矾即硫酸亚铁晶体,滤液为TiOSO4(aq),滤液加热,使TiOSO4水解生成H2TiO3固体,洗涤、干燥、煅烧得到TiO2,在一定条件下,将TiO2还原生成Ti,
(1)绿矾即硫酸亚铁晶体,化学式为FeSO4•7H2O,故答案为:FeSO4•7H2O;
(2)FeTi03与过量硫酸反应生成TiOSO4,FeSO4和H2O,离子方程式为:FeTiO3+4H+=Fe2++TiO2++2H2O;
故答案为:FeTiO3+4H+=Fe2++TiO2++2H2O;
(3)取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,说明没有Fe3+,再加H2O2后出现红色,说明有Fe3+,则原来含有Fe2+,加H2O2后Fe2+被氧化为Fe3+;H2TiO3中的二价铁易被氧化为三价铁,煅烧时会生成Fe2O3,TiO2含有少量的Fe2O3会呈现黄色;
故答案为:Fe2+;Fe2O3;
(4)反应中Ti元素化合价未变化,氯元素化合价由0价降低为-1价,令碳元素在产物中等化合价为a,则a=2×[0-(-1)],故a=2,反应中氧化剂与还原剂的物质的量之比为1:1,结合元素守恒可知,TiO2、Cl2、C、TiCl4的系数分别为1、2、2、1,所以未知物中含有C原子与O原子,碳元素化合价为+2,故为CO,故答案为:CO;
(5)为防止碳与氧气反应,应可绝空气加热(或惰性气氛中);金属钛中混有少量杂质镁,由题给信息知钛的化学活性很小,仅能与氧气等几种物质起反应,可用稀盐酸或稀硫酸除杂,故答案为:隔绝空气(或惰性气氛中); 稀盐酸或稀硫酸.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验的基本原理和物质的性质.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| A. | 标准状况下,22.4 L CO2和CO混合气体中含有的氧原子数为NA | |
| B. | 1mol Fe在过量的 C12中充分燃烧,转移的电子数为2NA | |
| C. | 0.1mol CH4所含的电子数为NA | |
| D. | 1 L lmol•L-1的Na2C03溶液中离子总数为3NA |
| A. | 当Al3+恰好完全沉淀时,消耗Ba(OH)2 1.5 mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为AlO2- | |
| C. | 当向溶液中加入1.5 mol Ba(OH)2时,反应可用下列离子方程式表示:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
| A. | x=0.5,a=10 | B. | x=1,a=5 | C. | x=2,a=10 | D. | x=0.5,a=8 |
| A. | 生产氢气的原料来源广泛 | |
| B. | 氢气燃烧时无污染 | |
| C. | 氢气易液化,贮存、携带方便 | |
| D. | 在等质量的可燃气体中,氢气燃烧时放出的热量多 |
(1)配制250mL0.1mol/L的盐酸溶液
| 应量取该浓盐酸体积/mL | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
A、用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B、用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C、将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是保证溶质全部转入容量瓶,溶液注入容量瓶前需恢复到室温,这是因为容量瓶盛放热溶液时,体积不准;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作偏低;若加蒸馏水时不慎超过了刻度线偏低;若定容时俯视刻度线偏高.
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线重新配制;向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面重新配制.
| A. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子 | |
| B. | 1 mol羟基中电子数为10NA | |
| C. | 标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g | |
| D. | 常温下,1 L 0.1 mol•L-1的NH4NO3溶液中氮原子数为0.2NA |