题目内容
16. 一定温度和电压下,电解精制食盐水可制取NaClO3.电解装置如图.已知:3Cl2+6OH-=ClO3-+5Cl-+3H2O.下列说法正确的是( )
一定温度和电压下,电解精制食盐水可制取NaClO3.电解装置如图.已知:3Cl2+6OH-=ClO3-+5Cl-+3H2O.下列说法正确的是( )| A. | 铁为阳极,电极反应式为2H2O+2e-=H2↑+2OH- | |
| B. | 若阴极产生3.36L(标况)气体,则溶液中的反应转移电子0.30mol | |
| C. | 电解槽内总反应方程式为:NaCl+3H2O $\frac{\underline{\;通电\;}}{\;}$NaClO3+3H2↑ | |
| D. | 用阳离子交换膜代替阴离子交换膜,也一样可以制得NaClO3 |
分析 由题给信息可知,电解时,铁应为阴极,发生还原反应生成氢气2H2O+2e-=H2↑+2OH-,阳极发生2Cl--2e-=Cl2,OH-向阳极移动,发生3Cl2+6OH-=ClO3-+5Cl-+3H2O,可制得NaClO3,总反应式为NaCl+3H2O $\frac{\underline{\;通电\;}}{\;}$NaClO3+3H2↑,以此解答该题.
解答 解:A.阳极发生氧化反应生成氯气,则铁应为阴极,否则被氧化生成亚铁离子,故A错误;
B.若阴极产生3.36L(标况)气体,为氢气,n(H2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,则生成0.15molCl2,溶液中发生3Cl2+6OH-=ClO3-+5Cl-+3H2O,由方程式可知转移0.25mol电子,故B错误;
C.电解时,阴极上氢离子放电,阳极上氯离子放电生成氯酸根离子,电池反应式为NaCl+3H2O $\frac{\underline{\;通电\;}}{\;}$NaClO3+3H2↑,故C正确;
D.用阳离子交换膜代替阴离子交换膜,OH-不能移向阳极移动,不能生成ClO3-,只能生成氯气,故D错误.
故选C.
点评 本题考查了电解原理,为高频考点,侧重于学生的分析、计算能力的考查,明确离子交换膜的作用及阴阳极上发生的反应是解本题关键,计算量较大,题目难度中等.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
7.以下离子:①H+ ②Cl- ③Al3+ ④K+ ⑤SO42- ⑥OH- ⑦NO3-⑧NH4+中,不影响水的电离平衡的是( )
| A. | ②④⑤⑦ | B. | ②④⑥⑦ | C. | ①⑤⑥⑦ | D. | ②④⑥⑧ |
4.下列说法不正确的是( )
| A. | 甘氨酸与丙氨酸在一定条件下发生取代反应,最多可以获得四种二肽 | |
| B. | 煤的干馏得到的煤焦油中可以分离出苯及苯的同系物,也可以分离出丙烯等石油化工原料 | |
| C. | 用原子吸收光谱可以确定物质中含有哪些金属元素 | |
| D. | 淀粉、麦芽糖水解后的最终产物都是葡萄糖 |
11.下列过程中没有发生化学反应的是( )
| A. | 用活性炭去除汽车内室的异味 | |
| B. | 用硝酸对钢船舱进行钝化处理 | |
| C. | 用经硫酸酸化处理的三氧化铬硅胶检验酒精 | |
| D. | 用小苏打溶水拌入面中一起蒸煮使馒头蓬松 |
1.下列关于常见有机物的说法正确的是( )
| A. | 分子式为C4H8的有机物有3种同分异构体(不考虑立体异构) | |
| B. | 汽油、煤油、柴油、甘油结构相似,性质相似 | |
| C. | -C(CH3)3的系统命名为1,1-二甲基乙基 | |
| D. | 聚乙烯塑料老化是因为发生了加成反应 |
8.化学与生活密切相关.下列说法中不正确的是( )
| A. | “雨后彩虹”是一种与光学和胶体性质相关的自然现象 | |
| B. | 纯银器表面在空气渐渐变暗,是电化学腐蚀所致 | |
| C. | 右图电流表指针偏转,有电流通过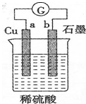 | |
| D. | 在食品中科学使用食品添加剂对人体无害 |
5.如图是一些常见有机物的转化关系,下列说法正确的是( )
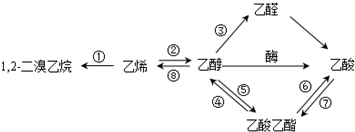

| A. | 反应①是加成反应,反应⑧是消去反应,其它所标明的反应都是取代反应 | |
| B. | 上述物质中能与NaOH溶液反应的只有乙酸 | |
| C. | 1,2一二溴乙烷、乙烯、乙醇烃基上的氢被氯取代,其一氯取代产物都是一种 | |
| D. | 等物质的量的乙烯和乙醇与足量氧气反应时耗氧量相同 |
6.苹果酸是-种常见的有机酸,结构简式为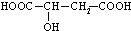 ,下列说法不正确的是( )
,下列说法不正确的是( )
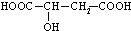 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 苹果酸能使紫色的石蕊试液变红 | |
| B. | 苹果酸能发生酯化反应 | |
| C. |  与苹果酸是同一种物质 与苹果酸是同一种物质 | |
| D. | 1mol苹果酸在一定条件下可与2molH2发生加成反应 |