题目内容
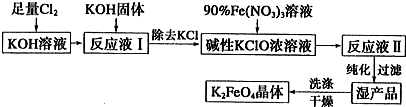
17.高铁酸钾是一种高效净水剂,具有强氧化性,能杀菌、消毒.在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如表所示:| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
①洗涤粗品时选用异丙醇而不用水的理由是:减少高铁酸钾的溶解损失.
②反应Ⅰ的离子方程式为Cl2+20H-=Cl-+ClO-+H2O.
③反应Ⅱ中氧化剂与还原剂之比为3:2.
④已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=3时,开始生成Fe(OH)3(不考虑溶液体积的变化).
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾.
①加入饱和KOH溶液的目的是:增大K+浓度,促进高铁酸钾晶体析出.
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠小(填“大”或“小”).
(3)请写出干法制备K2FeO4的化学反应方程式Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O.
分析 反应Ⅰ:2NaOH+Cl2═NaCl+NaClO+H2O,反应Ⅱ:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,加入饱和KOH溶液可以增大K+浓度,促进K2FeO4晶体析出.
(1)①高铁酸钾溶于水,不溶于异丙醇,减少产品的损耗;
②根据物质的性质写出反应的化学方程式,氯气和氢氧化钠溶液反应生成氯化钠,次氯酸钠和水;
③反应Ⅱ是次氯酸根离子在碱溶液中把铁离子氧化为高铁酸根离子;
④依据溶度积常数和铁离子浓度计算氢氧根离子浓度,结合离子积常数计算氢离子浓度得到铁离子沉淀的PH;
(2)①加入饱和KOH溶液增大反应物的浓度,使平衡右移;
②湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,说明高铁酸钾溶解度小;
(3)根据含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂,氧化铁、硝酸钾在氢氧化钾溶液中发生氧化还原反应生成K2FeO4、KNO2、和H2O.
解答 解:反应Ⅰ:2NaOH+Cl2═NaCl+NaClO+H2O,反应Ⅱ:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,加入饱和KOH溶液可以增大K+浓度,促进K2FeO4晶体析出.
(1)①洗涤粗品时选用异丙醇而不用水的理由是,高铁酸钾易溶于水,难溶于异丙醇,可以减少高铁酸钾的损耗,故答案为:减少高铁酸钾的溶解损失;
②氯气和氢氧化钠溶液反应生成氯化钠,次氯酸钠和水,反应的离子方程式为Cl2+20H-=Cl-+ClO-+H2O,故答案为:Cl2+20H-=Cl-+ClO-+H2O;
③ClO-在碱性条件下可将Fe3+氧化为FeO42-,反应方程式为,3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,反应中氧化剂与还原剂之比为3:2,
故答案为:3:2;
④25℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5mol/L,Ksp=c(Fe3+)×c3(OH-),c3(OH-)=$\frac{4.0×1{0}^{-38}}{4.0×1{0}^{-5}}$=10-33;c(OH-)=10-11mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$=10-3mol/L,铁离子沉淀的溶液pH=3,
故答案为:3;
(2)①加入饱和KOH溶液增大反应物K+的浓度,使平衡右移,促进K2FeO4晶体析出,故答案为:增大K+浓度,促进K2FeO4晶体析出;
②流程分析可知,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾,说明高铁酸钠溶解度大于高铁酸钾溶解度,高铁酸钾的溶解度比高铁酸钠小,故答案为:小;
(3)干法制备K2FeO4的化学反应为氧化铁、硝酸钾在氢氧化钾溶液中发生氧化还原反应,氮元素的化合价降低,铁元素的化合价升高,则KNO3为氧化剂,Fe2O3为还原剂,化学方程式为:Fe2O3+3KNO3+4KOH═2K2FeO4+3KNO2+2H2O,
故答案为:Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O.
点评 本题考查氧化还原反应,离子方程式、原电池电极反应的书写,化学平衡的移动,明确利用元素的化合价变化来分析氧化剂、还原剂时解答的关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
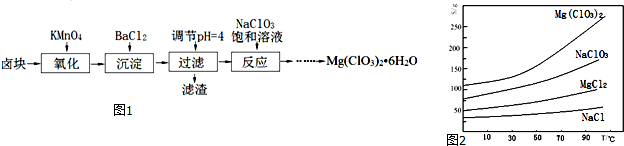
有关氢氧化物沉淀完全的pH见表
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| PH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
(2)上述工艺多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(3)①在“除杂Ⅰ”中,常用酸性KMnO4溶液,其目的是将Fe2+ 转化成为Fe3+,请写出该反应的离子方程式5Fe2++2MnO4-+16H+=2Mn2++5Fe3++8H2O.将溶液的pH调至4,目的是让三价铁转化为氢氧化铁沉淀而除去.②在“除杂Ⅱ”中,加入锌粉的目的是除去溶液中的Cu2+.
(4)在“碳化合成”中,产物中有碱式碳酸锌[Zn2(OH)2CO3]和CO2等,请写出该反应的化学方程式2Na2CO3+2Zn(NO3)2+H2O=[Zn2(OH)2CO3+CO2+4NaNO3.
Ⅰ.合成氨用的氢气有多种制取的方法:
①活泼金属(如钠)直接跟水反应;
②金属(如锌)跟稀盐酸或稀硫酸反应;
③电解水制氢气
④由焦炭跟水反应制取氢气:C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
⑤由天然气制取氢气:CH4+H2O(g)$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$CO+3H2
(1)请你再补充一种制取氢气的方法,写出该反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(2)已知有关反应的能量变化如图,则方法⑤反应的焓变△H=(a+3b-c)kJ•mol-1.

Ⅱ.在3个2L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:3H2(g)+N2(g)$\frac{\underline{\;高温高压\;}}{催化剂}$2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | 5 | 8 | |
| 平衡时N2的浓度(mol•L-1) | c1 | 1.5 | |
| NH3的体积分数 | ω1 | ω3 | |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
a.2c1>1.5mol/L b.2ρ1=ρ2 c.ω3=ω1
(4)在该温度下该反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}×(3{c}_{1}-1.5)^{3}}$(用含c1的代数式表示).
(5)容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol/(L.min).
Ⅲ.用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g)?CO (NH2)2(l)+H2O(g).某温度下,为进一步提高CO2的平衡转化率,下列措施中能达到目的是ab.
a.提高NH3的浓度 b.增大压强 c.及时转移生成的尿素 d.使用更高效的催化剂.
| A. | 2.5 mol | B. | 4.5 mol | C. | 5mol | D. | 7.5 mol |
| A. | SO2具有漂白性,可使紫色石蕊试液褪色 | |
| B. | 氧化铝、氧化镁可用作制耐火材料 | |
| C. | 可用瓷坩埚中加热熔化氢氧化钠固体 | |
| D. | 向溴水中滴入植物油,振荡后,油层显无色,说明溴不溶于油脂 |
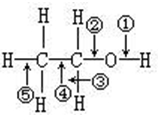 在一定条件下,一个乙醇分子断键只失去两个氢原子,生成的新有机化合物可能有(写结构简式,不一定填满)CH3CHO;
在一定条件下,一个乙醇分子断键只失去两个氢原子,生成的新有机化合物可能有(写结构简式,不一定填满)CH3CHO; ;CH2=CHOH;..
;CH2=CHOH;..