题目内容
7.下列有关实验和应用的说法正确的是( )| A. | SO2具有漂白性,可使紫色石蕊试液褪色 | |
| B. | 氧化铝、氧化镁可用作制耐火材料 | |
| C. | 可用瓷坩埚中加热熔化氢氧化钠固体 | |
| D. | 向溴水中滴入植物油,振荡后,油层显无色,说明溴不溶于油脂 |
分析 A.二氧化硫具有漂泊性,但是不能使指示剂褪色;
B.氧化铝、氧化镁熔点高;
C.瓷坩埚的含有二氧化硅,二氧化硅能够与氢氧化钠反应;
D.植物油中含C=C,与溴水发生加成反应.
解答 解:A.二氧化硫具有漂泊性,但是不能使指示剂褪色,故A错误;
B.氧化铝、氧化镁熔点高,耐高温,可以做耐火材料,故B正确;
C.瓷坩埚含有二氧化硅,二氧化硅可与氢氧化钠反应生成硅酸钠,故C错误;
D.植物油中含C=C,与溴水发生加成反应,则向溴水中滴入植物油,振荡后,褪色,不能说明溶解性,故D错误;
故选:B.
点评 本题考查了元素化合物知识,熟悉二氧化硫、氧化铝、氧化镁、二氧化硅、不饱和高级脂肪酸的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
17.高铁酸钾是一种高效净水剂,具有强氧化性,能杀菌、消毒.在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如表所示:
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
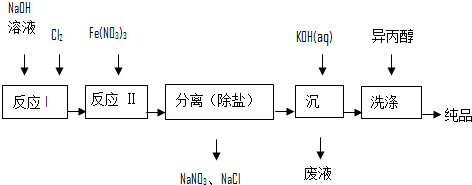
①洗涤粗品时选用异丙醇而不用水的理由是:减少高铁酸钾的溶解损失.
②反应Ⅰ的离子方程式为Cl2+20H-=Cl-+ClO-+H2O.
③反应Ⅱ中氧化剂与还原剂之比为3:2.
④已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=3时,开始生成Fe(OH)3(不考虑溶液体积的变化).
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾.
①加入饱和KOH溶液的目的是:增大K+浓度,促进高铁酸钾晶体析出.
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠小(填“大”或“小”).
(3)请写出干法制备K2FeO4的化学反应方程式Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O.
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |

①洗涤粗品时选用异丙醇而不用水的理由是:减少高铁酸钾的溶解损失.
②反应Ⅰ的离子方程式为Cl2+20H-=Cl-+ClO-+H2O.
③反应Ⅱ中氧化剂与还原剂之比为3:2.
④已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=3时,开始生成Fe(OH)3(不考虑溶液体积的变化).
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾.
①加入饱和KOH溶液的目的是:增大K+浓度,促进高铁酸钾晶体析出.
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠小(填“大”或“小”).
(3)请写出干法制备K2FeO4的化学反应方程式Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O.
18. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$.
(2)已知:K300℃>K350℃,则该反应是放热热反应.
(3)如图表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2b.适当升温c.增大O2的浓度d.选择催化剂.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)已知:K300℃>K350℃,则该反应是放热热反应.
(3)如图表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3mol•L-1•s-1.
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是c.
a.及时分离出NO2b.适当升温c.增大O2的浓度d.选择催化剂.
15.用过量的H2SO4、NaOH、NH3•H2O、NaCl等溶液,按图所示步骤分开五种离子,则溶液①②③④是( )

| A. | ①NaCl ②NaOH ③NH3•H2O ④H2SO4 | B. | ①H2SO4 ②NaOH ③NH3•H2O ④NaCl | ||
| C. | ①NaCl ②NH3•H2O ③NaOH ④H2SO4 | D. | ①H2SO4 ②NH3•H2O ③NaOH ④NaCl |
2.自2016年1月1日起将施行修订后的《中华人民共和国大气污染防治法》.下列有关说法错误的是( )
| A. | 开发新能源,如太阳能、风能等,减少对化石能源的依赖 | |
| B. | 直径接近于2.5×10-6m的颗粒物(PM2.5)分散在空气中形成的混合物具有丁达尔效应 | |
| C. | 燃煤进行脱硫、脱硝处理,减少硫氧化物和氮氧化物的排放 | |
| D. | 通过吸收空气中CO2并利用廉价能源合成汽油可推广“绿色自由”计划 |
19.某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如表所示,请回答:
(1)三次检测结果中第二次检测结果不正确.
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,需要向溶液中依次滴加HNO3溶液,Ba(NO3)2溶液,AgNO3溶液.(填化学式)
| 检测次数 | 溶液中检测结果 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
(2)在检测时,为了确定溶液中是否存在硫酸根离子、碳酸根离子和氯离子,需要向溶液中依次滴加HNO3溶液,Ba(NO3)2溶液,AgNO3溶液.(填化学式)
17.下列说法正确的是( )
| A. | 在常温、常压下,11.2LN2含有的分子数为0.5NA | |
| B. | 将80克NaOH溶于1L水中,所得溶液的物质的量浓度为2mol/L | |
| C. | 标准状况下,18gH2O的体积是22.4L | |
| D. | 标准状况下,20mlNH3与60ml O2所含分子个数比为1:3 |
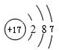 .
.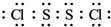 ;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,已知X是能使品红褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓.
;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,已知X是能使品红褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓.