题目内容
18.化学反应的实质是“旧键的断裂和新键的形成”.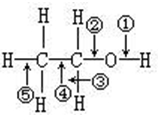 在一定条件下,一个乙醇分子断键只失去两个氢原子,生成的新有机化合物可能有(写结构简式,不一定填满)CH3CHO;
在一定条件下,一个乙醇分子断键只失去两个氢原子,生成的新有机化合物可能有(写结构简式,不一定填满)CH3CHO; ;CH2=CHOH;..
;CH2=CHOH;..根据你学习过的知识和提供的试剂、仪器,实现上述某一种转化,并验证该转化后的有机化台物.试剂:无水乙醇、光亮的铜丝、氢氧化钠溶液、硫酸铜溶液.仪器:试管、试管夹、镊子、胶头滴管、酒精灯、火柴.
乙醇的转化:
①实验方案是:取5mL无水乙醇加入试管中,将铜丝在酒精灯外焰上烧红后插入乙醇中,这样的操作反复进行多次,观察现象
②实验现象是:烧红了的铜丝离开火焰后呈黑色,从乙醇中取出的铜丝又呈红色,试管中的液体产生了刺激性气味
③乙醇转化的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
分析 乙醇分子中断裂①③键发生催化氧化反应;
断裂④⑤键生成碳碳双键,得到乙烯醇;
断裂①⑤键,生成环氧乙烷;
①乙醇在铜做催化剂条件下发生催化氧化生成乙醛,铜在反应中做催化剂,据此设计实验方案;
②实验现象为:烧红了的铜丝离开火焰后呈黑色,从乙醇中取出的铜丝又呈红色,试管中的液体产生了刺激性气味;
③依据乙醇在铜做催化剂条件下发生催化氧化生成乙醛,写出反应的方程式.
解答 解:乙醇分子中断裂①③键发生催化氧化反应,生成乙醛,结构简式为:CH3CHO;
断裂④⑤键生成碳碳双键,得到乙烯醇,结构简式为:CH2=CHOH;
断裂①⑤键,生成环氧乙烷,结构简式为: ;
;
故答案为:CH3CHO;CH2=CHOH; ;
;
乙醇在铜做催化剂条件下发生催化氧化生成乙醛,铜在反应中做催化剂,
①实验方案是:取5mL无水乙醇加入试管中,将铜丝在酒精灯外焰上烧红后插入乙醇中,这样的操作反复进行多次,观察现象;
故答案为:取5mL无水乙醇加入试管中,将铜丝在酒精灯外焰上烧红后插入乙醇中,这样的操作反复进行多次,观察现象;
②实验现象为:烧红了的铜丝离开火焰后呈黑色,从乙醇中取出的铜丝又呈红色,试管中的液体产生了刺激性气味;
故答案为:烧红了的铜丝离开火焰后呈黑色,从乙醇中取出的铜丝又呈红色,试管中的液体产生了刺激性气味;
③乙醇在铜做催化剂条件下发生催化氧化生成乙醛,化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查了乙醇的性质,结构决定性质,熟悉乙醇分子结构是解题关键,注意乙醇催化氧化反应中铜做催化剂,题目难度不大.

练习册系列答案
相关题目
12.下列物质在纯氧气里燃烧,恰好完全反应,生成物属于混合物的是( )
| A. | 镁条 | B. | 红磷 | C. | 蜡烛 | D. | 铁丝 |
14.下表中的实验能达到实验目的或能取出相应结论的是( )
| 选项 | 实验目的 | 实验目的或结论 |
| A | 向含有少量FeCl2的MgCl2溶液中加入足量NaOH溶液,搅拌后静置过滤 | 除去MgCl2溶液中少量FeCl2 |
| B |  | NaHCO3比Na2CO3受热更易分解 |
| C | 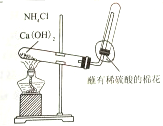 | 制取并收集氨气 |
| D | 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌,过滤,沉淀用蒸馏水洗涤 | 除去Mg(OH)2样品中Ca(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
17.高铁酸钾是一种高效净水剂,具有强氧化性,能杀菌、消毒.在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如表所示:
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
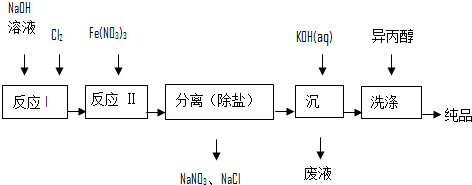
①洗涤粗品时选用异丙醇而不用水的理由是:减少高铁酸钾的溶解损失.
②反应Ⅰ的离子方程式为Cl2+20H-=Cl-+ClO-+H2O.
③反应Ⅱ中氧化剂与还原剂之比为3:2.
④已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=3时,开始生成Fe(OH)3(不考虑溶液体积的变化).
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾.
①加入饱和KOH溶液的目的是:增大K+浓度,促进高铁酸钾晶体析出.
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠小(填“大”或“小”).
(3)请写出干法制备K2FeO4的化学反应方程式Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O.
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |

①洗涤粗品时选用异丙醇而不用水的理由是:减少高铁酸钾的溶解损失.
②反应Ⅰ的离子方程式为Cl2+20H-=Cl-+ClO-+H2O.
③反应Ⅱ中氧化剂与还原剂之比为3:2.
④已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH=3时,开始生成Fe(OH)3(不考虑溶液体积的变化).
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾.
①加入饱和KOH溶液的目的是:增大K+浓度,促进高铁酸钾晶体析出.
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠小(填“大”或“小”).
(3)请写出干法制备K2FeO4的化学反应方程式Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O.
 现用质量分数为98%、密度为1.84g/cm3的浓H2SO4配制500mL 0.2mol/L的稀H2SO4.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④药匙 ⑤量筒 ⑥托盘天平 ⑦胶头滴管 ⑧250mL容量瓶.请回答下列问题:
现用质量分数为98%、密度为1.84g/cm3的浓H2SO4配制500mL 0.2mol/L的稀H2SO4.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④药匙 ⑤量筒 ⑥托盘天平 ⑦胶头滴管 ⑧250mL容量瓶.请回答下列问题: 甲、乙、丙是三种单质,其中甲是固体;乙、丙是气体;A、B、C、D、E都是化合物,很多建筑物因含有E而受到酸雨的侵蚀.上述物质的相互转化关系如图所示(部分产物已略去):
甲、乙、丙是三种单质,其中甲是固体;乙、丙是气体;A、B、C、D、E都是化合物,很多建筑物因含有E而受到酸雨的侵蚀.上述物质的相互转化关系如图所示(部分产物已略去): 剂
剂