题目内容
15.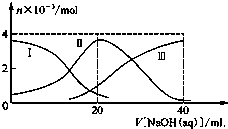 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )| A. | 当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | H2A第一步电离的方程式为H2A→HA-+H+ | |
| D. | 向NaHA溶液加入水稀释的过程中,pH可能增大也可能减少 |
分析 A.根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,c(A2-)>c(H2A),HA-的电离程度大于HA-的水解程度,溶液显酸性;
B.等体积等浓度的NaOH溶液与H2A溶液混合后,溶质为NaHA,根据图象可知c(A2-)>c(H2A),溶液显示酸性,然后根据溶液中酸或碱抑制水电离,含有弱根离子的盐水解促进水电离进行判断;
C.NaHA溶液显示酸性,H2A为弱酸存在电离平衡;
D.根据图象可知,NaHA溶液显示酸性,向NaHA溶液加人水的过程中,其电离程度增大,但是溶液中氢离子浓度减小,溶液的pH一定增大.
解答 解:A.当V(NaOH)=20 mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液中溶质为NaHA,由于c(A2-)>c(H2A),所以HA-电离程度大于水解,溶液显酸性,则溶液中离子浓度大小为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故A正确;
B.等体积等浓度的NaOH溶液与H2A溶液混合后,由图示关系知,c(A2-)>c(H2A),说明电离大于水解程度,c(H+)>c(OH-),溶液显酸性,溶液中氢离子抑制了水的电离,溶液中水的电离程度比纯水小,故B错误;
C.由图示关系知,NaHA溶液中c(A2-)>c(H2A),溶液显示酸性,说明HA-电离大于水解,H2A第一步电离的方程式为H2A?HA-+H+,故C错误;
D.NaHA溶液加人水的过程中,HA-电离程度增大,但是溶液中氢离子浓度减小,溶液的pH增大,故D错误;
故选A.
点评 本题考查酸碱混合溶液定性判断,为高考常见题型,题目难度中等,试题侧重于学生的分析能力的考查,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可.

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案| A. | 实验室欲配制480mL0.10mol•L-1的CuSO4溶液,可用12.0g胆矾及相应容器配制 | |
| B. | 将适量FeCl3饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体 | |
| C. | 实验室中从海带里提取碘的过程是:灼烧→溶解→过滤→萃取 | |
| D. | 用分液漏斗、烧杯、铁架台(带铁圈)、饱和Na2CO3溶液可除去乙酸乙酯中的乙酸 |
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | 离O点越远的元素原子半径越大 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | A、B组成的化合物中可能含有共价键 |
| A. | 苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为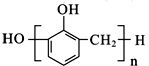 | |
| B. | (NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 | |
| C. | 醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物 | |
| D. | 迷迭香酸的结构为  它可以发生酯化、水解、加成等反应 它可以发生酯化、水解、加成等反应 |
| A. | 乙烯可催熟水果 | |
| B. | SO2、CO2和NO2都可形成酸雨 | |
| C. | 盐析可提纯蛋白质并保持其生理活性 | |
| D. | 通过石油的裂解可获得乙烯、丙烯 |
| A. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | B. | 苯的结构简式:C6H6 | ||
| C. | 硅的原子结构示意图: | D. | Na2S的电子式: |
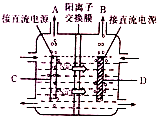 氯碱工业是基础化学工业,其产品广泛用于化工、冶金、造纸、纺织、石油等工业.
氯碱工业是基础化学工业,其产品广泛用于化工、冶金、造纸、纺织、石油等工业.