题目内容
6. 氯碱工业是基础化学工业,其产品广泛用于化工、冶金、造纸、纺织、石油等工业.
氯碱工业是基础化学工业,其产品广泛用于化工、冶金、造纸、纺织、石油等工业.(1)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等杂质,所以在进入电解槽前需要进行精制,通常可以选用Na2CO3、NaOH、BaCl2作为除杂质的试剂,则加入三种试剂的先后顺序为NaOH、BaCl2、Na2CO3或者BaCl2、NaOH、Na2CO3;加入Na2CO3后所发生反应的离子方程式为CO32-+Ca2+=CaCO3↓、CO32-+Ba2+=BaCO3↓;若食盐水不经过精制就直接进入离子膜电解槽,可能出现的后果是粗盐水中含有钙离子、镁离子,在碱性环境下生成沉淀,堵塞损坏离子交换膜.
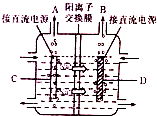
(2)如图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极用碳钢网制成),则B处产生气体的化学式为H2,C电极的名称是阳极,电解总反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH;
(3)从阳极槽出来的淡盐水往往含有少量的溶解氯,需要加入8%-9%的亚硫酸氢钠溶液将其彻底除去,该反应的离子方程式为HSO3-+Cl2+H2O=SO42-+3H++2Cl-;
(4)已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342t/m3)113m3,电解槽的电流强度为1.45×104A,则该电解槽的电解效率η(NaOH)=93.46%.[提示:η=(产品的实际产量/产品的理论产量)×100%].
分析 (1)粗盐提纯时加试剂的原则是:碳酸钠一定加在氯化钡之后;
碳酸钠与钙离子、钡离子反应分别生成碳酸钙、碳酸钡沉淀;
粗盐水中含有钙离子、镁离子,而电解食盐水生成碱,镁离子、钙离子能够在碱性环境下生成沉淀,堵塞损坏离子交换膜,所以食盐水应进行精制才能进入离子膜电解槽;
(2)依据图装置分析,钠离子移向D极,说明D为阴极,C为阳极,D电极析出的是氢气;电解氯化钠溶液生成氢氧化钠、氯气和氢气;
(3)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠;
(4)依据转移电子数计算生成NaOH的质量,根据理论耗电量和实际耗电量计算.
解答 解:(1)粗盐提纯,应用氢氧化钠除去镁离子,氯化钡除去硫酸根离子,用碳酸钠除去过量的钡离子,所以碳酸根离子一定放在氯化钡之后,正确顺序为:
NaOH、BaCl2、Na2CO3;或者BaCl2、NaOH、Na2CO3;
碳酸钠与钙离子、钡离子反应分别生成碳酸钙、碳酸钡沉淀,离子方程式:CO32-+Ca2+=CaCO3↓、CO32-+Ba2+=BaCO3↓;
粗盐水中含有钙离子、镁离子,而电解食盐水生成碱,镁离子、钙离子能够在碱性环境下生成沉淀,堵塞损坏离子交换膜,所以食盐水应进行精制才能进入离子膜电解槽;
故答案为:NaOH、BaCl2、Na2CO3或者BaCl2、NaOH、Na2CO3;CO32-+Ca2+=CaCO3↓、CO32-+Ba2+=BaCO3↓;粗盐水中含有钙离子、镁离子,在碱性环境下生成沉淀,堵塞损坏离子交换膜;
(2)依据图装置分析,钠离子移向D极,说明D为阴极,D电极氢离子得到电子发生还原反应生成氢气;
依据图装置分析,钠离子移向D极,说明D为阴极,C为阳极;
电解氯化钠溶液生成氢氧化钠、氯气和氢气,电解方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH;
故答案为:H2;阳极;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2NaOH;
(3)氯气具有氧化性,能将亚硫酸钠氧化为硫酸钠,化学方程式为:Na2SO3+Cl2+H2O=Na2SO4+2HCl,离子方程式为:HSO3-+Cl2+H2O=SO42-+3H++2Cl-,
故答案为:HSO3-+Cl2+H2O=SO42-+3H++2Cl-;
(4)烧碱溶液总含氢氧化钠的实际质量为:1.342×106×113×32%=48.53×106kg;
理论上生成氢氧化钠的质量为:1.492×1.45×104×300×8=51.92×106kg;
该电解槽的电解效率η(NaOH)=$\frac{48.53×1{0}^{6}}{51.92×1{0}^{6}}$×100%=93.46%;
故答案为:93.46%.
点评 本题以氯碱工业为载体,考查了粗盐的提纯,电解饱和食盐水的原理,明确离子反应的实质以及电解池工作原理,准确判断电极及发生反应是解题关键,题目难度中等.

 一线名师权威作业本系列答案
一线名师权威作业本系列答案| A. | Ag+、Cl- | B. | H+、SO42- | C. | Na+、CO32- | D. | Ba2+、Cl- |
| A. | 用容量瓶配制溶液时,必须先用该溶液润洗 | |
| B. | 在蒸馏实验时常加入碎瓷片以防止暴沸 | |
| C. | 可用碱式滴定管量取20.00mLKMnO4溶液 | |
| D. | 分液操作中,待下层液体流出后,再将上层液体从分液漏斗下口放出 |
| A. | 1H2、2H2--同位素 | B. | HCOOCH3、CH3OCHO--同分异构体 | ||
| C. | S2-、S22---同素异形体 | D. | 甲基丙烯酸、油酸--同系物 |
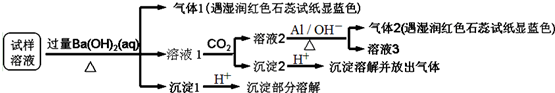
根据以上的实验操作与现象,该同学得出的结论错误的是( )
| A. | 试样中肯定存在NH4+、SO42-和NO3-,可能有Mg2+ | |
| B. | 试样中不一定存在Na+、Cl-、HCO3- | |
| C. | 沉淀2中可能含碳酸钡、碳酸镁和氢氧化铝 | |
| D. | 该雾霾中可能存在NaNO3、NH4HCO3和MgSO4 |
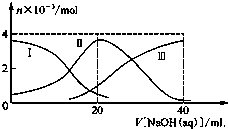 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )| A. | 当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | H2A第一步电离的方程式为H2A→HA-+H+ | |
| D. | 向NaHA溶液加入水稀释的过程中,pH可能增大也可能减少 |
| A. | 使甲基橙变红色的溶液:Mg2+、Fe2+、SO42-、NO3- | |
| B. | 弱碱性溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 使石蕊显紫色的溶液:Al3+、K+、SO42-、HCO3- | |
| D. | 0.1mol•L-1NaAlO2溶液:H+、Na+、Cl-、SO42- |