题目内容
5.下列叙述中正确的是( )| A. | 实验室欲配制480mL0.10mol•L-1的CuSO4溶液,可用12.0g胆矾及相应容器配制 | |
| B. | 将适量FeCl3饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体 | |
| C. | 实验室中从海带里提取碘的过程是:灼烧→溶解→过滤→萃取 | |
| D. | 用分液漏斗、烧杯、铁架台(带铁圈)、饱和Na2CO3溶液可除去乙酸乙酯中的乙酸 |
分析 A.依据m=CVM计算需要溶质的质量;
B.搅拌能够使胶体聚沉;
C.碘以离子形式存在,需要加氧化剂氧化;
D.乙酸能够与碳酸钠溶液反应生成易溶于水的乙酸钠,乙酸乙酯不溶于饱和碳酸钠溶液.
解答 解:A.实验室没有480mL的容量瓶,应选择大于480mL且规格相近的容量瓶,故应选择500mL容量瓶;需要胆矾的质量为0.1mol•L-1×0.5L×250g/mol=12.5g,故A错误;
B.将适量FeCl3饱和溶液滴入沸水中并不断搅拌,搅拌能够使胶体聚沉所以不能得到胶体,故B错误;
C.碘以离子形式存在,需要加氧化剂氧化,则从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→氧化→萃取,故C错误;
D.饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇,反应后分液,则给出的仪器可完成分液操作,故D正确;
故选:D.
点评 本题考查化学实验方案的评价,明确实验原理是解题关键,注意对相关实验知识的积累,题目难度不大.

练习册系列答案
相关题目
14.将甲乙两种有机物组成的混合物进行分离,已知甲乙的某些特征如下:
则应采取的分离方法是( )
| 物质 | 密度/(g•mL-1) | 沸点 | 水溶性 | 溶解性 |
| 甲 | 0.893 | 78.5℃ | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7℃ | 溶 | 溶于甲 |
| A. | 蒸馏 | B. | 升华 | C. | 分液 | D. | 过滤 |
13.有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为( )
| A. | 7:1 | B. | 7:2 | C. | 7:3 | D. | 7:4 |
20.X、Y、Z、W是原子序数依次增大的前20号元素,X、Y同周期,Y、Z同主族,X原子的最外层电子数为内层电子数的2倍,Y是地壳中含量最多的元素,W为金属元素,且原子中无成单电子,下列叙述不正确的是( )
| A. | Z的离子半径比W的离子半径小 | |
| B. | 第一电离能:X<Y | |
| C. | Y的氢化物的沸点比Z的氢化物沸点高 | |
| D. | 室温时,WXY3在纯水存在沉淀溶解平衡 |
10.大气污染再次成为今年“两会”的热门议题.下列做法不能改善大气环境的是( )
| A. | 大力开发新能源和可再生能源 | |
| B. | 城市大力发展轨道交通,少开私家车 | |
| C. | 清洁燃煤、提高燃油品质 | |
| D. | 学校、家庭安装空气净化装置 |
17.下列各组离子在水溶液中能发生反应的是( )
| A. | Ag+、Cl- | B. | H+、SO42- | C. | Na+、CO32- | D. | Ba2+、Cl- |
15.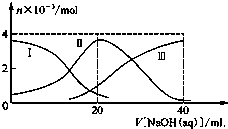 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )| A. | 当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | H2A第一步电离的方程式为H2A→HA-+H+ | |
| D. | 向NaHA溶液加入水稀释的过程中,pH可能增大也可能减少 |