��Ŀ����
���������˵����������ϳɰ����ķ��������1918���ŵ������ѧ����
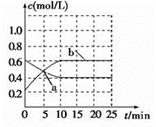
N2(g)+3H2(g) 2NH3(g) ��H<0����ͼ��ʾij�¶�ʱ����1L�����м���1mol������3mol�������÷�Ӧ��110S�ڷ�Ӧ���еij̶ȣ�
2NH3(g) ��H<0����ͼ��ʾij�¶�ʱ����1L�����м���1mol������3mol�������÷�Ӧ��110S�ڷ�Ӧ���еij̶ȣ�
��1���˷�Ӧ��50��60sʱ��ѧƽ�ⳣ��ΪK1 = ���г�����ʽ�������㣩��
��2����Ӧ���е�60sʱ���ı������������ ��
�ڸ������£������Ļ�ѧ��Ӧ���� �������С����������䡱��
��3���÷�Ӧ��80s��ѧƽ�ⳣ��ΪK2����K1 K2(�>������<����=��)����ʱ������ת����Ϊ ��
��4������110s�����ƽ����ϵ���ټ���1mol���������ٴδ�ƽ�������ƽ����ϵ�е�������� �������С����������䡱��
N2(g)+3H2(g)
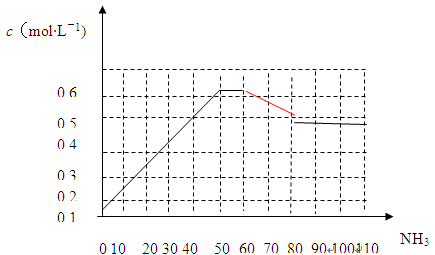
 2NH3(g) ��H<0����ͼ��ʾij�¶�ʱ����1L�����м���1mol������3mol�������÷�Ӧ��110S�ڷ�Ӧ���еij̶ȣ�
2NH3(g) ��H<0����ͼ��ʾij�¶�ʱ����1L�����м���1mol������3mol�������÷�Ӧ��110S�ڷ�Ӧ���еij̶ȣ�
��1���˷�Ӧ��50��60sʱ��ѧƽ�ⳣ��ΪK1 = ���г�����ʽ�������㣩��
��2����Ӧ���е�60sʱ���ı������������ ��
| A��������� | B��������������� |
| C�������¶� | D����С������Ũ�� |
��3���÷�Ӧ��80s��ѧƽ�ⳣ��ΪK2����K1 K2(�>������<����=��)����ʱ������ת����Ϊ ��
��4������110s�����ƽ����ϵ���ټ���1mol���������ٴδ�ƽ�������ƽ����ϵ�е�������� �������С����������䡱��
��1��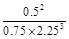 (2) C ��� (3) > 20% (4)���
(2) C ��� (3) > 20% (4)���
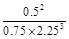 (2) C ��� (3) > 20% (4)���
(2) C ��� (3) > 20% (4)��������������1��50��60sʱ����Ӧ�ﵽƽ��״̬��
N2(g)+3H2(g)
 2NH3(g) ��H<0
2NH3(g) ��H<0ʼ��mol�� L��1�� 1 3
�䣨mol�� L��1�� 0.25 0.75 0.5
ƽ��mol�� L��1�� 0.75 2.25 0.5
K=
 =
=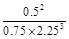 ��
����2��60-80sʱc(NH3)��С�����ִﵽƽ��״̬��������ƽ���ƶ���Ӱ�죬A�����������������c(NH3)˲���С����ԭƽ�ⲻ������B���������¶ȣ�ƽ�������ƶ���c(NH3)��С��C��ȷ����С����Ũ�ȣ�c(NH3)�ȼ�С������D����
��3���÷�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ�KԽС��80s��c(NH3)=0.4mol��L��1��ת����N2Ϊ0.2mol��N2ת����Ϊ0.2��
��4��ƽ����ټӰ������൱�ڶ��¶���ʱ�ٳ���N2��H2����Ч������ѹǿ��ƽ�������ƶ���������ƽ����ϵ�������������
������ƽ�ⳣ�����¶��йء�

��ϰ��ϵ�д�
 ֥�鿪���γ�������ϵ�д�
֥�鿪���γ�������ϵ�д� ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�
�����Ŀ
 2AB2(g) �ﵽƽ��״̬�ı�־�� ( )
2AB2(g) �ﵽƽ��״̬�ı�־�� ( ) 2Z(g)+W(s)��������������ȷ����
2Z(g)+W(s)��������������ȷ���� N2O4��g�� ��H��298K��=-52.7kJ��mol-1��ij����С��Ϊ��̽���¶Ⱥ�ѹǿ�Ի�ѧƽ���Ӱ�죬������������ʵ�飺
N2O4��g�� ��H��298K��=-52.7kJ��mol-1��ij����С��Ϊ��̽���¶Ⱥ�ѹǿ�Ի�ѧƽ���Ӱ�죬������������ʵ�飺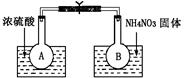
 pC(��)��ƽ������������С��ԭ����
pC(��)��ƽ������������С��ԭ���� �����ﵽ��ƽ��ʱ��C��Ũ��Ϊԭ����1.9������ѹ�������б����¶Ȳ��䣬��Ӧ����ʽ������ϵ����ϵ�ǣ� ��
�����ﵽ��ƽ��ʱ��C��Ũ��Ϊԭ����1.9������ѹ�������б����¶Ȳ��䣬��Ӧ����ʽ������ϵ����ϵ�ǣ� ��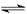 CO2��g����H2��g�����õ������������ݣ�
CO2��g����H2��g�����õ������������ݣ�
 nC(g)�ķ�Ӧ��ϵ�У�C�İٷֺ���(c%)��ʱ��t����������ͼ��ʾ�����������ȷ����
nC(g)�ķ�Ӧ��ϵ�У�C�İٷֺ���(c%)��ʱ��t����������ͼ��ʾ�����������ȷ����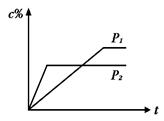
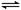 N2O4(g) ��H<0���ֽ�NO2��N2O4 �������ͨ������ܱ������У���Ӧ������Ũ����ʱ��ı仯��ͼ������˵����ȷ����
N2O4(g) ��H<0���ֽ�NO2��N2O4 �������ͨ������ܱ������У���Ӧ������Ũ����ʱ��ı仯��ͼ������˵����ȷ����