题目内容
(6分)在容积为10L的密闭容器中,通入40molN2和120molH2,在一定条件下进行反应,2s后达到平衡状态,此时N2的浓度是2mol/L,试求:
(1)用H2的浓度变化表示的2s内的平均反应速率为多少?
(2)N2的转化率为多少?
(3)平衡时NH3的体积分数为多少?(要求有计算过程)
(1)用H2的浓度变化表示的2s内的平均反应速率为多少?
(2)N2的转化率为多少?
(3)平衡时NH3的体积分数为多少?(要求有计算过程)
解: (1)
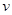 (
(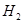 )="3mol" ?L-1 ?s-1
)="3mol" ?L-1 ?s-1(2)N2的转化率="50%"
(3) NH3的体积分数=33.3%
试题分析:本题是关于可逆反应中的计算题,利用“三段法”来对反应中三个状态时的各物质的浓度进行分析,从而来进行计算。由题意已知了N2的初始浓度,而在反应2S后达到平衡状态,此时N2的浓度是2mol/L,根据N2浓度的变化即可进行计算。根据化学反应中计量数之比等于化学反应速率之比可以用其它物质来对化学反应速率进行描述。
解题过程如下:
2秒后N2的物质的量为2mol/L×10L=20mol
N2 + 3H2 = 2NH3
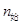 40 120 0
40 120 0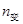 20 60 40
20 60 40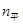 20 60 40
20 60 40(1)
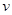 (
(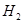 )=
)=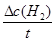 =
=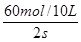 ="3mol" ?L-1 ?s-1
="3mol" ?L-1 ?s-1 (2)N2的转化率:N2%=
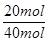 ×100%=50%
×100%=50% (3) NH3的体积分数:NH3%=
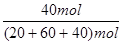 =33.3%
=33.3% 点评:本题属于平衡计算题目,常用的方法就是三段式的解法,可以清晰的判断各个过程中物质的量的变化,并进行计算,属于常规解题方法。

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
 pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是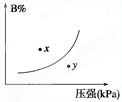
 2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。
2E(g);ΔH<0。为了使平衡向生成E的方向移动,最适宜的条件是①高温;②低温;③高压;④低压;⑤加催化剂;⑥除去E。 2Z(g),X2、Y2、Z起始浓度分别为0.2mol·L—1、 0.6mol·L—1、0.4mol·L—1,当平衡时,下列数据肯定不正确的是 ( )
2Z(g),X2、Y2、Z起始浓度分别为0.2mol·L—1、 0.6mol·L—1、0.4mol·L—1,当平衡时,下列数据肯定不正确的是 ( ) xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。(1)x = (2)从反应开始到40s达平衡状态,A的平均反应速率为 (3)平衡时容器中B的体积分数为 (4)该温度下此反应的平衡常数表达式为 数值是 (5)下列各项能表示该反应达到平衡状态是
xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。(1)x = (2)从反应开始到40s达平衡状态,A的平均反应速率为 (3)平衡时容器中B的体积分数为 (4)该温度下此反应的平衡常数表达式为 数值是 (5)下列各项能表示该反应达到平衡状态是 
 2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度: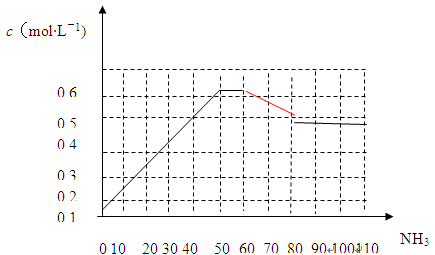
 N
N ,下列不能说明反应达到了平衡状态的是
,下列不能说明反应达到了平衡状态的是