题目内容
某温度下,一定量的混合气体在密闭容器中发生如下反应:mA(气)+nB(气)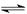 pC(气)达平衡后,将气体体积缩小到原来的
pC(气)达平衡后,将气体体积缩小到原来的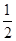 ,当达到新平衡时,C的浓度为原来的1.9倍,其压缩过程中保持温度不变,则反应方程式中两边系数关系是: 。
,当达到新平衡时,C的浓度为原来的1.9倍,其压缩过程中保持温度不变,则反应方程式中两边系数关系是: 。
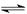 pC(气)达平衡后,将气体体积缩小到原来的
pC(气)达平衡后,将气体体积缩小到原来的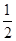 ,当达到新平衡时,C的浓度为原来的1.9倍,其压缩过程中保持温度不变,则反应方程式中两边系数关系是: 。
,当达到新平衡时,C的浓度为原来的1.9倍,其压缩过程中保持温度不变,则反应方程式中两边系数关系是: 。 m+n<p。
【错解分析】m+n>p
【正解】温度一定,气体的体积缩小到原来的二分之一,所有物质的浓度都发生相应的变化,相当于给体系加压,应从压强条件改变,引起平衡移动进行讨论。但讨论某物质的浓度变化时,不仅要从平衡移动方面(化学变化)考虑。还要从压强引起体积变化,进而引起浓度变化(物理因素)方面考虑。若从单方面分析,必然得出错误的结论。如:仅从加压引起平衡移动考虑,C的浓度为原来的1.9倍,一定是平衡向正反应方向移动的结果,反应物气体的总物质的量大于生成物气体的总物质的量,即m+n=p。
本题考虑到体积缩小到原来的二分之一这一瞬间,所有物质的浓度将增大到原来的二倍,C的浓度也应为原来的二倍。题目给的有关达到新平衡时C的浓度为原来的1.9倍,意味着平衡是向逆反应方向移动。因此,结论为:m+n<p。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
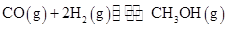 。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。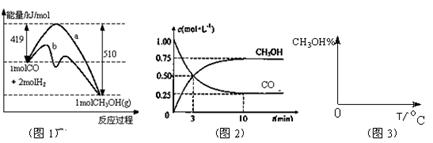
 CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数 (填“增大”、“减小”或“不变”)。 2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度:
2NH3(g) △H<0。下图表示某温度时,向1L容器中加入1mol氮气,3mol氢气,该反应在110S内反应进行的程度: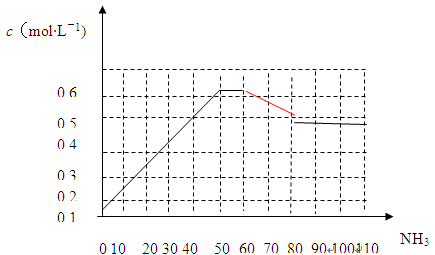
 CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol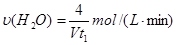

 2C(g)+4D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=1.21V L。请回答:
2C(g)+4D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)=1.21V L。请回答:
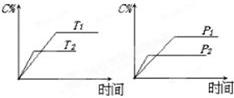
 2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是
2C(g)+D(g),其中a为正整数。反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是