题目内容
19. 联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.(1)有效“减碳”的手段之一是节能.下列制氢方法最节能的是C.(填字母序号)
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
B.高温使水分解制氢:2H2O$\frac{\underline{\;高温\;}}{\;}$2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
D.天然气制氢:CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2
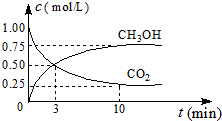
(2)CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①写出由CO2和H2制取甲醇的反应的平衡常数表达式$\frac{[C{H}_{3}OH]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]^{3}}$_
②从3min到10min,v(H2)=0.11mol/(L•min).
③能说明上述反应达到平衡状态的是D(选填编号)
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗3molH2,同时生成1molH2O
D.CO2的体积分数在混合气体中保持不变
④下列措施中能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大的是CD(选填编号)
A.升高温度
B.恒温恒容充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入1molCO2和3molH2
(3)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一.
2CO2(g)+6H2(g)→CH3Och3(g)+3H2O.有人设想利用二甲醚制作燃料电池,以KOH溶液做电解质溶液,试写出该电池工作时负极反应的电极反应方程式C2H6O+16OH--12e-═2CO32-+11H2O.
分析 (1)最节能的方法是利用太阳能;
(2)①化学平衡常数K=$\frac{生成物浓度系数幂次方}{反应物浓度系数幂次方}$;
②根据图象计算v(CO2),根据反应速率之比等于化学计量数之比计算;
③当达到化学平衡状态时,正逆反应速率相等,各物质的浓度不变,以此判断;
④能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大,应使平衡向正反应方向移动;
(3)电池负极应为二甲醚的氧化反应.
解答 解:(1)太阳光是取之不尽用之不竭的能源,利用太阳能制备氢气应为最节能的方法,故答案为:C;
(2)①化学平衡常数K=$\frac{生成物浓度系数幂次方}{反应物浓度系数幂次方}$=$\frac{[C{H}_{3}OH]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]^{3}}$,故答案为:$\frac{[C{H}_{3}OH]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]^{3}}$;
②v(CO2)=$\frac{0.25mol/L}{7min}$,则v(H2)=3v(CO2)=3×$\frac{0.25mol/L}{7min}$=0.11mol/(L•min),
故答案为:0.11;
③A.由图可知反应中CO2与CH3OH的物质的量浓度之比为1:1时,并未达到平衡状态,故A错误;
B.因气体的质量不变,容器的体积不变,则无论是否达到平衡状态,都存在混合气体的密度不随时间的变化而变化,不能判断是否达到平衡状态,故B错误;
C.无论是否达到平衡状态,都存在单位时间内每消耗3molH2,同时生成1molH2O,故C错误;
D.CO2的体积分数在混合气体中保持不变,说明达到平衡状态,故D正确.
故答案为:D;
④A.升高温度,平衡向逆反应方向移动,则比值减小,故A错误;
B.恒温恒容充入He(g),平衡不移动,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方向移动,故C正确;
D.恒温恒容再充入1mol CO2和3mol H2,相当于在原来基础上缩小体积,压强增大,平衡向正反应方向移动,故D正确,
故答案为:CD;
(3)电池负极应为二甲醚的氧化反应,在碱性条件下生成CO32-,电极反应式为C2H6O+16OH--12e-═2CO32-+11H2O,
故答案为:C2H6O+16OH--12e-═2CO32-+11H2O.
点评 本题综合考查化学平衡以及电化学知识,题目难度较大,注意反应速率的计算、平衡状态的判断以及化学平衡的计算方法,利用平衡常数计算为解答该题的关键.

 阅读快车系列答案
阅读快车系列答案| A. | 硝酸钠和金刚石 | B. | 冰和干冰 | C. | 晶体硅和水晶 | D. | 萘和苯 |
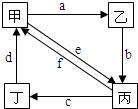 如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 甲 | 乙 | 丙 | 丁 | |
| ① | Cu | CuO | CuCl2 | Cu(NO3)2 |
| ② | Na2CO3 | NaOH | NaHCO3 | CO2 |
| ③ | (NH4)2SO3 | CaSO3 | SO2 | NH4HSO3 |
| ④ | Al(OH)3 | Al2O3 | NaAlO2 | AlCl3 |
| A. | ①②③④ | B. | 仅②③④ | C. | 仅②④ | D. | 仅③④ |
| A. | 乙烯和甲烷可用酸性高锰酸钾溶液鉴别 | |
| B. | 乙酸和油脂都能与氢氧化钠溶液反应 | |
| C. | 2-戊烯存在顺反异构现象 | |
| D. | 乙烯和苯都能与酸性高锰酸钾溶液、溴水反应 |
| A. | s电子的原子轨道都是球形的,2s电子比1s电子能量高且电子云比1s更扩散 | |
| B. | p电子的原子轨道都是纺锤形的,每个p能级有3个原子轨道,它们相互垂直能量相同 | |
| C. | 当电子排布在同一能级的不同轨道,总是优先单独占据一个轨道,而且自旋方向相反 | |
| D. | 在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋方向相反 |
| A. | 高压有利于氨的合成 | |
| B. | 实验室中常用排饱和食盐水的方式收集氯气 | |
| C. | 打开汽水瓶,有气泡从溶液中冒出 | |
| D. | 向双氧水中加入二氧化锰有利于氧气的生成 |
| A. | C2H2 | B. | C3H6 | C. | C7H8 | D. | C2H4 |