题目内容
11.下列事实中,不能用勒夏特列原理解释的是( )| A. | 高压有利于氨的合成 | |
| B. | 实验室中常用排饱和食盐水的方式收集氯气 | |
| C. | 打开汽水瓶,有气泡从溶液中冒出 | |
| D. | 向双氧水中加入二氧化锰有利于氧气的生成 |
分析 勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关,则不能用勒夏特利原理解释.
解答 解:A.合成氨反应是气体体积减小的反应,合成氨工厂学采用增大压强以提高原料的利用率,可以用勒夏特列原理解释,故A不选;
B.实验室可用排饱和食盐水的方法收集氯气,氯气和水的反应是可逆反应,饱和氯化钠溶液中氯离子浓度大,化学平衡逆向进行,减小氯气溶解度,能用勒沙特列原理解释,故B不选;
C.因溶液中存在二氧化碳的溶解平衡,开启汽水瓶后,压强减小,二氧化碳逸出,能用勒夏特列原理解释,故C不选;
D.二氧化锰作催化剂,只影响反应速率,不影响平衡移动,所以不能用平衡移动原理解释,故D选;
故选D.
点评 本题考查化学平衡移动原理,为高频考点,明确化学平衡原理适用范围是解本题关键,注意:平衡移动原理只适用于改变条件能引起平衡移动的可逆反应,为易错点.

练习册系列答案
相关题目
2.下列实验方案的设计中,不正确的是( )
| A. | 用灼烧法鉴别羊毛纤维和棉纤维 | |
| B. | 用适量稀硫酸清除铁制品表面的铁锈 | |
| C. | 用适量熟石灰除去氯化钠溶液中少量的碳酸钠 | |
| D. | 用足量稀盐酸检验久置的氢氧化钠固体是否变质 |
6.低合金高强度钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等合金元素,下列有关说法正确的是( )
| A. | 工业上利用热还原法冶炼金属Fe、Cr、Mn | |
| B. | Fe位于元素周期表的第四周期、第ⅧB族 | |
| C. | ${\;}_{22}^{46}$TiO2、${\;}_{22}^{48}$TiO2、${\;}_{22}^{50}$TiO2互为同位素 | |
| D. | ${\;}_{41}^{92}$Nb3+原子核内有51个中子,核外有44个电子 |
20.把Ca(OH)2溶入蒸馏水中,一定时间后达到以下平衡:Ca(OH)2(s)?Ca2++2OH-,加入以下溶液,可使Ca(OH)2(s)减少的是( )
| A. | CaO | B. | AlCl3 | C. | NaOH | D. | CaCl2 |
17.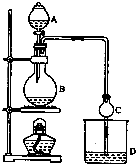 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是酸性、催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3CO18OH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H218O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)采用分液(操作名称)法从 D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出乙醇;再加入(从下列选项中选择)C,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是酸性、催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3CO18OH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H218O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)采用分液(操作名称)法从 D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出乙醇;再加入(从下列选项中选择)C,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
18.下列微粒中,既含有离子键又含有共价键的是( )
| A. | NH3 | B. | NH4Cl | C. | H2S | D. | KCl |
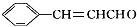 ,在催化剂存在条件下1mol D与2mol H2反应可以生成乙;丙中含有两个-CH3
,在催化剂存在条件下1mol D与2mol H2反应可以生成乙;丙中含有两个-CH3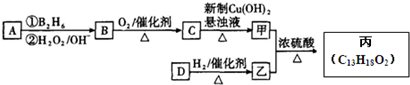
 .
. .
.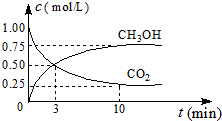 联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.