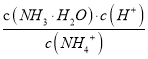题目内容
【题目】I.联氨(N2H4,常温下是无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)已知12.8 g的液态高能燃料联氨在氧气中燃烧,生成气态N2和液态水,放出248.8kJ的热量。写出表示液态联氨燃烧热的热化学方程式___________________。
(2)已知①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=___________,联氨和N2O4可作为火箭推进剂的主要原因为_____________。
Ⅱ.现有反应:mA(g)+nB(g)![]() pC(g).达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g).达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_______热反应,且m+n_____p(填“>”“=”“<”)。
(2)若加入B(体积不变),则A的转化率______,B的转化率____(填“增大”“减小”或“不变”)。
(3)若升高温度,则平衡时B、C的浓度之比![]() 将_________。
将_________。
(4)若加入催化剂,平衡时气体混合物的总物质的量_________。
【答案】 N2H4 (l) + O2(g) = N2(g) + 2H2O(l) △H= —622.0 kJ/mol 2ΔH3-2ΔH2-ΔH1 反应放热量大、产生大量气体 放 >; 增大 减小 减小 不变
【解析】I.(1)反应方程式为:N2H4+2H2O2═N2+4H2O,0.4mol液态肼放出248.8kJ的热量,则1mol液态肼放出的热量为![]() =622kJ,所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-622kJ/mol,故答案为:N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-622kJmol-1;
=622kJ,所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-622kJ/mol,故答案为:N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-622kJmol-1;
(2)①2O2(g)+N2(g)═N2O4(l)△H1,②N2(g)+2H2(g)═N2H4(l)△H2,③O2(g)+2H2(g)═2H2O(g)△H3,依据热化学方程式和盖斯定律计算③×2-②×2-①得到④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=2△H3-2△H2-△H1,根据反应④可知,联氨和N2O4反应放出大量热且产生大量气体,因此可作为火箭推进剂,故答案为:2△H3-2△H2-△H1;反应放热量大,产生大量气体;
Ⅱ.(1)升高温度时,B的转化率变大,说明平衡正向移动,正反应为吸热反应,则逆反应为放热反应;当减小压强时,混合体系中C的质量分数也减小,说明平衡逆向进行,逆反应是气体体积增大的反应.则m+n>p;故答案为:放;>;
(2)若加入B,A的转化率增大,B本身的转化率减小;故答案为:增大,减小;
(3)当升高温度时,B的转化率变大,平衡正向进行,说明正反应是吸热反应,比值![]() 减小;故答案为:减小;
减小;故答案为:减小;
(4)催化剂对化学平衡移动没有影响,所以若加入催化剂,平衡时气体混合物的总物质的量不变,故答案为:不变。