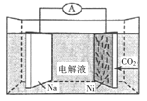
题目内容
【题目】氧化还原反应在含氯物质的制取、含量测定等方面有重要的作用。
⑴将一定量的氯气通入过量NaOH溶液中,由于副反应的存在,溶液中同时存在Cl-、ClO-和ClO3-。若Cl-、ClO-和ClO3-的物质的量分别为a mol、b mol和c mol,根据电子得失守恒可知a、b、c之间一定存在的等量关系是______。
⑵工业次氯酸钠溶液中含有氯酸钠会影响产品质量。测定次氯酸钠样品中的氯酸钠含量的过程如下:
步骤Ⅰ:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将ClO-完全还原成Cl-(ClO3-在该条件不与H2O2反应),加热煮沸,冷却至室温,加入硫酸至酸性,
步骤Ⅱ:向步骤Ⅰ所得溶液中加入0.1000 mol·L-1硫酸亚铁溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点,消耗该溶液20.00 mL。
已知步骤Ⅱ中涉及的相关反应转化为:ClO3-![]() Cl-,Cr2O72-
Cl-,Cr2O72-![]() Cr3+,则碱性NaClO溶液试样中所含NaClO3的物质的量浓度为______mol·L-1。
Cr3+,则碱性NaClO溶液试样中所含NaClO3的物质的量浓度为______mol·L-1。
⑶NaClO2广泛用于造纸工业、污水处理等,可由ClO2为原料反应制得。某溶液X中同时含有ClO2和NaClO2,为测定其中ClO2-的浓度,现进行如下实验:
步骤1:量取25.00 mL溶液X,调节溶液的pH为8.0,加入足量的KI晶体(发生反应:2ClO2+2I-=2ClO2-+I2)。滴入2滴淀粉溶液,滴加0.02000 mol·L-1Na2S2O3溶液(发生反应:2Na2S2O3+I2=Na2S4O6+2NaI)。恰好完全反应时,消耗Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0(发生反应:ClO2-+4H++4I-=Cl-+2I2+2H2O),滴加0.2500 mol·L-1Na2S2O3溶液。恰好完全反应时,消耗Na2S2O3溶液40.00 mL。请计算溶液X中ClO2-的物质的量浓度(写出计算过程)。_______
【答案】a=b+5c 0.028 0.09mol·L-1
【解析】
(1)根据电子转移数守恒作答;
(2)先根据氧化还原反应中电子转移数守恒求出各物质之间的关系式,再计算;
(3)设25.00 mLY中含有xmol C1O2、ymol ClO2-,根据关系式和元素守恒列式计算。
(1)将一定量的氯气通入过量NaOH溶液中,发生歧化反应,0价的Cl元素化合价升高为+1价和+5价分别转移1、5个电子,同时降低为-1价,转移1个电子,若Cl-、ClO-和ClO3-的物质的量分别为a mol、b mol和c mol,则根据电子转移数相等可得,![]() ,即a=b+5c;
,即a=b+5c;
(2)酸性Cr2O7溶液滴定剩余的Fe2+,根据电子转移数可知,![]() ,故n剩(Fe2+)=0.01000 mol·L-1
,故n剩(Fe2+)=0.01000 mol·L-1![]() 0.02L
0.02L![]() 6=1.2
6=1.2![]() 10-3 mol,因n总(Fe2+)=0.1000 mol·L-1
10-3 mol,因n总(Fe2+)=0.1000 mol·L-1![]() 0.03L==3.0
0.03L==3.0![]() 10-3 mol,则与ClO3-反应的Fe2+的物质的量n消耗(Fe2+)= n总(Fe2+)- n剩(Fe2+)=1.8
10-3 mol,则与ClO3-反应的Fe2+的物质的量n消耗(Fe2+)= n总(Fe2+)- n剩(Fe2+)=1.8![]() 10-3mol,ClO3-与Fe2+反应的关系式为:
10-3mol,ClO3-与Fe2+反应的关系式为:![]() ,故n(ClO3-)=
,故n(ClO3-)=![]() n消耗(Fe2+)=0.0003mol,则碱性NaClO溶液试样中所含NaClO3的物质的量浓度为
n消耗(Fe2+)=0.0003mol,则碱性NaClO溶液试样中所含NaClO3的物质的量浓度为![]() =0.03mol·L-1;
=0.03mol·L-1;
(3)根据反应:2ClO2+2I-![]() 2ClO2-+I2、ClO2-+4H++4I-
2ClO2-+I2、ClO2-+4H++4I-![]() Cl-+2I2+2H2O、2Na2S2O3+I2
Cl-+2I2+2H2O、2Na2S2O3+I2![]() Na2S4O6+2NaI,设25.00 mLX中含有xmol C1O2、ymol ClO2-,则
Na2S4O6+2NaI,设25.00 mLX中含有xmol C1O2、ymol ClO2-,则
步骤1、2ClO2----I2-----2Na2S2O3
2 2
x ![]()
步骤2、ClO2-----2I2-----4Na2S2O3
1 4
x+y ![]()
x=![]()
x+y=![]()
y=![]() ,c(ClO2-)=
,c(ClO2-)=![]() =0.09mol/L。
=0.09mol/L。

 阅读快车系列答案
阅读快车系列答案【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成
【题目】已知:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
n(N2O5)/mol | 10.0 | 7.0 | 5.0 | 5.0 |
下列说法正确的是( )
A.在1000s内,反应吸收的热量为2.5Q kJ
B.在500s内,O2分解速率为3×10-3 mol·L-1·s-1
C.在1000s时,反应恰好达到平衡
D.在1500s时,N2O5的正反应速率等于NO2的逆反应速率