题目内容
【题目】运用盖斯定律可计算一些不易测定的反应的反应热。
(1)已知在298K时下述反应的有关数据:C(s) +![]() O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)=2NO2(g) △H=+67.7 kJ·mol-l;
N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H=-534 kJ·mol-l。
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为___________________。
【答案】172.5 kJ·mol-1 2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g) △H=-1135.7 kJ ·mol-1
【解析】
(1)已知:①C(s) +![]() O2(g)=CO(g) △H1=-110.5 kJ·mol-1,
O2(g)=CO(g) △H1=-110.5 kJ·mol-1,
②C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1;
利用盖斯定律,将①×2-②,可得 C(s)+CO2(g)═2CO(g),
则:△H=-110.5kJ/mol×2+393.5kJ/mol=+172.5 kJ/mol;
(2)已知:①N2(g) + 2O2(g)=2NO2(g) △H=+67.7 kJ·mol-l;
②N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H=-534 kJ·mol-l;
由盖斯定律,②×2-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),故该反应的△H=2×(-534kJmol-1)-67.7kJmol-1)=-1135.7 kJmol-1,
即2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJmol-1。

 阅读快车系列答案
阅读快车系列答案【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大________min(填“0~1”,“1~2”,“2~3”,“3~4”或“4~5”),原因是______________________________。
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是________(填字母)。
A.蒸馏水 B.KCl溶液
C.KNO3溶液 D.Na2SO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
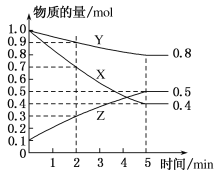
①该反应的化学方程式是_______________。
②该反应达到平衡状态的标志是________(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1molY的同时消耗2molZ
③2min内Y的转化率为________。
【题目】下表是元素周期表的一部分,X、Y、Z、W为短周期主族元素,W的原子序数是Z的2倍。下列说法中正确的是
X | Y | Z | ||
W |
A.简单离子半径:Y<Z
B.Y元素的最高价氧化物对应的水化物在一定条件下可以和X单质反应
C.氢化物的沸点:X<Z
D.WZ2具有漂白性,其漂白原理与双氧水相同