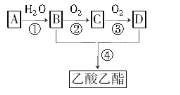
题目内容
【题目】已知:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) ΔH=+Q kJ/mol(Q>0),某温度下,向2L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
n(N2O5)/mol | 10.0 | 7.0 | 5.0 | 5.0 |
下列说法正确的是( )
A.在1000s内,反应吸收的热量为2.5Q kJ
B.在500s内,O2分解速率为3×10-3 mol·L-1·s-1
C.在1000s时,反应恰好达到平衡
D.在1500s时,N2O5的正反应速率等于NO2的逆反应速率
【答案】A
【解析】
A.由表中数据可知,在1000s内,消耗n(N2O5)为5.0mol,根据反应方程式可知,每消耗2molN2O5,反应吸收的热量为QkJ,则消耗5.0mol N2O5,反应吸收的热量为2.5QkJ,A项正确;
B.根据表中数据,500s时,n(N2O5)为7.0mol,N2O5的反应速率=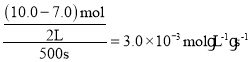 ,根据同一反应各物质的速率之比等于化学反应方程式各物质的计量数之比,可知用O2表示的反应速率=
,根据同一反应各物质的速率之比等于化学反应方程式各物质的计量数之比,可知用O2表示的反应速率=![]() ,B项错误;
,B项错误;
C.对比1000s和1500s时n(N2O5)的值,可知反应达平衡状态,但在1000s时反应不一定恰好达到平衡状态。C项错误;
D.对比1000s和1500s时n(N2O5)的值,可知1500s时反应达平衡状态,根据同一反应各物质的速率之比等于化学反应方程式各物质的计量数之比,可知v正(N2O5)=2v正(NO2),反应达平衡时,v正(NO2)=v逆(NO2),则v正(N2O5)=2v逆(NO2),D项错误;
答案选A。

【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
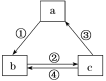
选项 | a | b | c | 箭头上所标数字的反应条件 |
A | AlCl3 | NaAlO2 | Al(OH)3 | ①加入过量的NaOH |
B | Si | SiO2 | H2SiO3 | ②常温加水 |
C | NaOH | NaHCO3 | Na2CO3 | ③加澄清石灰水 |
D | Fe | FeCl3 | FeCl2 | ④加入氯气 |
A.AB.BC.CD.D