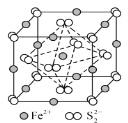
题目内容
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为___。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是___(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液![]() NaClO3溶液
NaClO3溶液![]() KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:NaCl+H2O电解NaClO3+ 。___。
②II中转化的基本反应类型是___,该反应过程能析出KClO3晶体而无其它晶体析出的原因是___。
(4)一定条件,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。

①D是___(填离子符号)。
②B→A+C反应的离子方程式为___。
【答案】![]() bc NaCl+3H2O=NaClO3+3H2↑ 复分解反应 室温下,氯酸钾在水中的溶解度明显小于其它晶体 ClO4- 3ClO-=ClO3-+2Cl-
bc NaCl+3H2O=NaClO3+3H2↑ 复分解反应 室温下,氯酸钾在水中的溶解度明显小于其它晶体 ClO4- 3ClO-=ClO3-+2Cl-
【解析】
(1)与氯元素同族的短周期元素是氟元素,其原子结构示意图为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)元素非金属性强弱判断方法:①与H2化合越容易,气态氢化物越稳定,非金属性越强,②单质的氧化性越强或阴离子的还原性越弱,非金属性越强,③最高价氧化物对应水化物的酸性越强,非金属性越强,与物质的沸点、氢化物水溶液的酸性无关,则bc符合题意,故答案为:bc;
(3)①电解时,阳极上Cl-放电生成ClO3-,阴极上H+放电生成H2,故反应方程式为NaCl+3H2O=NaClO3+3H2↑,故答案:NaCl+3H2O=NaClO3+3H2↑;
②NaClO3转化为KClO3,说明该反应中两种物质互相交换离子生成盐,为复分解反应;相同温度下,溶解度小的物质先析出。室温下,KClO3在水中的溶解度小于其他晶体,所以先析出KClO3,故答案为:复分解反应;室温下,KClO3在水中的溶解度明显小于其他晶体;
(4)①根据图象可知,D中Cl元素的化合价为+7价,所以ClOx-中的x为4,则D为ClO4-,故答案为:ClO4-;
②B→A+C,根据图像可知为:ClO-→Cl-+ClO3,根据电子守恒可知该反应方程式为:3ClO =2Cl +ClO3,故答案为:3ClO-=ClO3-+2Cl-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
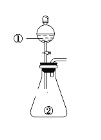
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D | 草酸溶液(H2C2O4具有还原性) | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
A.AB.BC.CD.D
【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
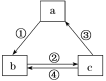
选项 | a | b | c | 箭头上所标数字的反应条件 |
A | AlCl3 | NaAlO2 | Al(OH)3 | ①加入过量的NaOH |
B | Si | SiO2 | H2SiO3 | ②常温加水 |
C | NaOH | NaHCO3 | Na2CO3 | ③加澄清石灰水 |
D | Fe | FeCl3 | FeCl2 | ④加入氯气 |
A.AB.BC.CD.D
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大________min(填“0~1”,“1~2”,“2~3”,“3~4”或“4~5”),原因是______________________________。
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是________(填字母)。
A.蒸馏水 B.KCl溶液
C.KNO3溶液 D.Na2SO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是_______________。
②该反应达到平衡状态的标志是________(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1molY的同时消耗2molZ
③2min内Y的转化率为________。