题目内容
【题目】A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示。
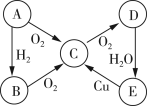
(1)如果A是淡黄色固体,回答下列问题。
①写出A、E的化学式:A________、E________。
②C→D的化学方程式为____________。
③将足量的物质C通入BaCl2溶液中,下列说法正确的是________(填字母序号)。
a.溶液中出现白色沉淀
b.溶液没有明显变化
c.若继续通入Cl2或NH3,则溶液中均出现白色沉淀
(2)如果A是无色气体,回答下列问题。
①D→E的化学方程式为_______。
②E→C的离子方程式为_______。
【答案】S H2SO4 2SO2+O2![]() 2SO3 bc 3NO2+H2O=2HNO3+NO 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
2SO3 bc 3NO2+H2O=2HNO3+NO 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【解析】
(1)如果A是淡黄色固体,A与氧气反应生成C,则A为S,C为SO2,根据题中转化关系,A与H2反应生成B为H2S,C与O2反应生成D为SO3,D与水反应生成E为H2SO4,浓硫酸与铜加热条件下反应生成SO2,符合转化关系;
(2)如果A是无色气体,根据题中转化关系,A能与氢气也能和氧反应,则A应为N2,B为NH3,C为NO,D为NO2,E为HNO3,铜与稀硝酸反应生成NO,符合转化关系,据此进行答题。
(1)根据以上分析,A为S,B为H2S,C为SO2,D为SO3,E为H2SO4;
①A的化学式是S,E的化学式是H2SO4;
②C为SO2,SO2与O2在催化剂存在条件下发生氧化反应产生SO3,该反应为可逆反应,故C→D的化学方程式为:2SO2+O2![]() 2SO3;
2SO3;
③将足量的物质SO2通入BaCl2溶液中,由于亚硫酸酸性比盐酸弱,所以二者不反应,但若继续通入Cl2或NH3,Cl2具有氧化性将溶解在溶液中的SO2氧化成SO42-与BaCl2溶液反应生成白色硫酸钡沉淀;NH3具有碱性,能够与SO2反应生成SO32-,再与BaCl2溶液反应生成白色BaSO3沉淀,则溶液中均出现白色沉淀,故合理选项是bc;
(2)根据上述分析可知A为N2,B为NH3,C为NO,D为NO2,E为HNO3。
①D为NO2,E为HNO3,NO2溶于水,反应产生HNO3和NO,则D→E的化学方程式为3NO2+H2O=2HNO3+NO;
②C为NO,E为HNO3,E→C的反应为铜与稀硝酸反应生成硝酸铜、NO气体和水,反应离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。

【题目】下表是元素周期表的一部分,X、Y、Z、W为短周期主族元素,W的原子序数是Z的2倍。下列说法中正确的是
X | Y | Z | ||
W |
A.简单离子半径:Y<Z
B.Y元素的最高价氧化物对应的水化物在一定条件下可以和X单质反应
C.氢化物的沸点:X<Z
D.WZ2具有漂白性,其漂白原理与双氧水相同