题目内容
【题目】硼是新型无机材料中的明星元素。

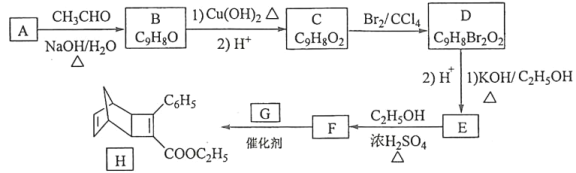
(1)磷化硼是一种耐磨涂料,可由三溴化硼和三溴化磷高温下在氢气中反应合成,其化学方程式为 ______,图为磷化硼晶体结构中最小的重复单元,磷化硼的晶体类型是 ______,一个晶胞中含 ______个P原子,每个B或P均形成4个共价键,其中有一个配位键,提供空轨道的是 ______原子。
(2)氮化硼是一种重要的功能陶瓷材料,其结构与磷化硼相似,B和N相比,电负性较大的是 ______(填元素符号),其基态原子的电子排布式为 ______,氮化硼中B元素的化合价为 ______。
(3)环硼氮烷与苯是等电子体,其一氯代物有两种结构、二氯代物有四种结构,写出环硼氮烷分子结构式 ______。
(4)BF3用作有机合成中的催化剂,也用于制造火箭的高能燃料。在BF3分子中,F-B-F的键角是 ______ 度,B原子采用 ______ 杂化;BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为 ______。
【答案】BBr3+PBr3+3H2![]() BP+6HBr 原子晶体 4 B N 1s22s22p3 +3
BP+6HBr 原子晶体 4 B N 1s22s22p3 +3  120 sp2 正四面体
120 sp2 正四面体
【解析】
(1)反应物是三溴化硼、三溴化磷和氢气,反应条件是高温,生成物是BP,根据元素守恒知还生成HBr,根据反应物、生成物及反应条件书写方程式;原子晶体的构成微粒是原子,为空间网状结构;根据图知,该晶胞中P原子个数=8×![]() +6×
+6×![]() =4,P原子含有孤电子对、B原子含有空轨道;
=4,P原子含有孤电子对、B原子含有空轨道;
(2)同一周期元素,元素电负性随着原子序数增大而增大;N原子核外有7个电子,根据构造原理书写其基态原子核外电子排布式;氮化硼中N元素化合价为-3价,则B元素化合价为+3价;
(3)环硼氮烷与苯是等电子体,根据苯的结构写出BN的大致结构,再根据一氯代物、二氯代物结构确定N、B原子在环上交叉出现,从而确定其结构简式;
(4)在BF3分子中,B原子价层电子对个数为3且不含孤电子对,所以为平面正三角形结构,据此计算F-B-F的键角及原子杂化方式,BF4-中B原子价层电子对个数是4且不含孤电子对,其空间构型是正四面体。
(1)反应物是三溴化硼、三溴化磷和氢气,反应条件是高温,生成物是BP,根据元素守恒知还生成HBr,根据反应物、生成物及反应条件书写方程式为BBr3+PBr3+3H2![]() BP+6HBr;原子晶体的构成微粒是原子,为空间网状结构,所以BP是原子晶体;根据图知,该晶胞中P原子个数=8×
BP+6HBr;原子晶体的构成微粒是原子,为空间网状结构,所以BP是原子晶体;根据图知,该晶胞中P原子个数=8×![]() +6×
+6×![]() =4,P原子含有孤电子对、B原子含有空轨道,所以提供空轨道的原子是B原子;
=4,P原子含有孤电子对、B原子含有空轨道,所以提供空轨道的原子是B原子;
(2)同一周期元素,元素电负性随着原子序数增大而增大,所以B和N两种元素,N元素电负性较大;N原子核外有7个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p3;BN中N元素化合价为-3价,则B元素化合价为+3价;
(3)环硼氮烷与苯是等电子体,根据苯的结构,再根据一氯代物、二氯代物结构确定N、B原子在环上交叉出现,从而确定其结构简式为 ;
;
(4)在BF3分子中,B原子价层电子对个数为3且不含孤电子对,所以为平面正三角形结构,所以F-B-F的键角为120°;原子杂化方式为sp2,BF4-中B原子价层电子对个数是4且不含孤电子对,其空间构型是正四面体。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】某实验小组制备草酸晶体(H2C2O4·2H2O)的实验装置如下:
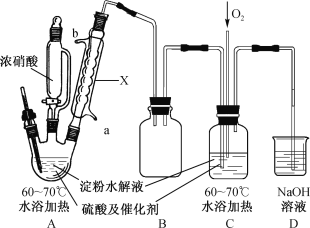
已知:I.草酸(H2C2O4)是二元弱酸,熔点101~102℃;
II.草酸的溶解度如下表所示:
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 |
溶解度/g·(100g水)-1 | 9.5 | 14.3 | 21.2 | 31.4 | 46.0 | 84.5 |
III.在催化剂和硫酸存在下,用浓硝酸氧化淀粉水解液可制备草酸,发生的主要反应为:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O。
回答下列问题:
(1)装置A中仪器X名称为___________,水从接口___________(填“a”或“b”)进入。
(2)装置B的作用是___________;设计装置C的目的是_________________________。
(3)反应C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O中,每生成1 mol H2C2O4转移电子的物质的量为____________。
(4)将装置A和C中反应液浓缩、静置结晶并过滤得粗草酸晶体,提纯H2C2O4·2H2O的方法是_________________________。
(5)探究草酸的性质:
①向Na2CO3溶液中滴加H2C2O4溶液,产生大量气体,说明草酸的酸性比碳酸________(填“强”或“弱”)。
②向NaClO溶液中加入过量H2C2O4溶液,有气泡产生,能解释这一现象的离子方程式为___。