题目内容
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,研读如图,下列判断错误的是
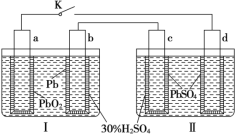
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.当电路中转移0.2mol电子时,Ⅰ中消耗的H2SO4为0.2mol
C.K闭合时,Ⅱ中SO42-向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,c电极为负极
【答案】C
【解析】
根据铅蓄电池的工作原理,Ⅰ池中,a电极为正极,b电极为负极,K闭合后,Ⅱ池中,c电极为阴极,d电极为阳极。
A.K闭合时,d电极为阳极,PbSO4失电子生成PbO2等,电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42-,A正确;
B.Ⅰ中电池反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,2H2SO4~2e-,所以当电路中转移0.2mol电子时,消耗的H2SO4为0.2mol,B正确;
C.K闭合时,Ⅱ中SO42-向阳极移动,即向d电极迁移,C错误;
D.K闭合一段时间后,Ⅱ的电极材料分别为Pb(c电极)、PbO2(d电极),电解质为H2SO4,所以可单独作为原电池,且c电极为负极,D正确;
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
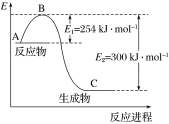
(1)上图是N2(g)和H2(g)反应生成1 mol NH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:______________。
(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-a kJ·mol-1①
N2(g)+O2(g)===2NO(g) ΔH2=-b kJ·mol-1②
若1 mol NH3还原NO至N2,则该反应过程中的反应热ΔH3=________ kJ·mol-1(用含a、b的式子表示)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g) ![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g) ![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) ![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________。