题目内容
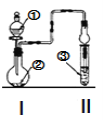
【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
① | ② | ③ | II中实验现象 |
| |
A | 浓盐酸 | 碳酸钙 | 滴有酚酞的稀碳酸钠溶液 | 溶液由红色变为浅红色 | |
B | 浓氨水 | 氧化钙 | 硫酸亚铁溶液 | 产生大量白色沉淀 | |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 | |
D | NH4Cl溶液 | NaAlO2溶液 | 紫色石蕊试液 | 溶液由紫色变为蓝色 |
A. AB. BC. CD. D
【答案】D
【解析】
A.反应生成二氧化碳气体,且盐酸易挥发,二氧化碳、盐酸均与碳酸钠反应,则碱性减弱,观察到Ⅱ中溶液由红色最终变为无色,故A错误;
B.反应生成氨气,氨气与硫酸亚铁溶液反应生成Fe(OH)2白色沉淀,然后变为灰绿色,最终变为红褐色Fe(OH)3沉淀,故B错误;
C.酯化反应需要加热,则图中装置没有加热装置,不能生成乙酸乙酯,故C错误;
D.NH4Cl溶液和NaAlO2溶液混合后生成Al(OH)3白色沉淀,同时逸出氨气,氨气的水溶液显碱性,遇紫色石蕊试液显蓝色,故D正确;
故答案为D。

 考前必练系列答案
考前必练系列答案【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。
【题目】近年来,中国华北华中地区发生了严重的雾霾天气。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0,在一定温度下,在一体积恒定的密闭容器中充入一定量的NO(g)和CO(g)在t1时刻达到平衡状态。若要同时提高该反应的速率和NO(g)的转化率,可采取的措施_______________。(写一条)
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积恒定的密闭容器中充入一定量的NO(g)和CO(g)在t1时刻达到平衡状态。若要同时提高该反应的速率和NO(g)的转化率,可采取的措施_______________。(写一条)
(2)改变煤的利用方式可减少环境污染,通常可将煤气化转化为水煤气,其反应原理为:C(s)+H2O(g)![]() CO(g)+H2(g) ; △H=+131.3kJ/mol。
CO(g)+H2(g) ; △H=+131.3kJ/mol。
①该反应在_________下能自发进行(填“高温”或“低温”)。
②水煤气燃烧过程中产生的CO2气体可以与“84消毒液”的主要成分NaClO发生反应,该反应的离子方程式为:___________________________________________________。(已知:HClO:Ka=3.0×10ˉ8;H2CO3:Ka1=4.30×10ˉ7;Ka2=5.61×10ˉ11)
(3)已知反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | |
CO | H2O | H2 | |||
1 | 650 | 4 | 2 | 1.6 | 6 |
2 | 900 | 2 | 1 | 0.4 | 3 |
3 | 900 | a | b | c | t |
①实验1条件下平衡常数K=________________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ____0(填“<”或“>”);若900℃时,另做一组实验,在此容器中加入10molCO,5mo1H2O,2mo1CO2,5molH2,此时v(正) ___v(逆)