题目内容
【题目】工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。
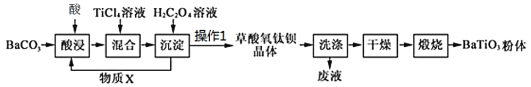
(1)“酸浸”应选择_________(填标号);为提高酸浸率,可采取的措施_________(至少答两点)
a. 硫酸 b. 盐酸 c. 硝酸
(2)实验室要完成操作1需要的玻璃仪器有_________。
(3)加入H2C2O4溶液时,发生的反应为______+______TiCl4+_____H2C2O4+ _____H2O= BaTiO(C2O4)2·4H2O↓ + _________;可循环使用的物质X是(写名称)_________。
(4)请简述检验草酸氧钛钡晶体是否洗涤干净的方法_________。
(5)高温煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成的气体产物有CO、和_________。
(6)测定钛酸钡粉体中BaTiO3的质量分数。
已知:Ba2++CrO42-=BaCrO4↓ 2CrO42-+2H+=Cr2O72-+H2O
现取a g煅烧后的BaTiO3粉末酸溶得到100.0 mL含Ba2+的溶液,取25.00 mL于锥形瓶,加入x mL 浓度为C1 mol/L的Na2CrO4溶液(Na2CrO4过量)充分反应后,用浓度为C2 mol/L标准盐酸滴定至CrO42-被完全反应,消耗盐酸体积为y mL。(钛元素不干扰测定过程)已知BaTiO3的摩尔质量为M g/mol,试写出粉体中BaTiO3质量分数的表达式。_________
【答案】b 适当加热、搅拌、将固体粉碎、适当提高酸的浓度 漏斗、玻璃棒、烧杯 1BaCl2 1 2 5 6HCl 盐酸 取最后一次洗涤流出液于试管,加入少量硝酸酸化的AgNO3溶液,若试管中无白色浑浊出现,则证明已经洗涤干净 CO2、H2O ![]()
【解析】
由制备流程可知,碳酸钡与盐酸反应生成氯化钡,然后氯化钡与四氯化钛、草酸反应生成BaTiO(C2O4)24H2O,过滤、洗涤、干燥、煅烧得到BaTiO3。
(1)碳酸钡与盐酸反应生成氯化钡、水、二氧化碳,根据物质的存在状态及影响速率的因素分析采取的措施;
(2)分离难溶性固体与液体混合物的操作是过滤,使用的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)向BaCl2、TiCl4混合溶液中加入H2C2O4溶液生成草酸氧钛钡晶体,同时生成HCl可循环使用;
(4)草酸氧钛钡晶体是从含HCl的溶液中过滤出来的,可用硝酸银检验沉淀是否洗涤干净;
(5)根据元素守恒,结合物质组成及元素的化合价分析判断生成物;
(6)根据给出的方程式,计算出25.00 mL溶液中含有的Ba2+的物质的量,然后根据物质总体积与实验时的体积关系及样品质量,得到其质量分数表达式。
(1)根据流程图可知使用的酸为盐酸,序号为b;为加快反应速率,采取的措施可以是将固体粉碎、搅拌、升高反应温度、增大酸的浓度等措施;
(2)操作1是过滤,过滤时使用的玻璃仪器有漏斗、玻璃棒、烧杯;
(3)根据流程图可知:向BaCl2、TiCl4混合溶液中加入H2C2O4溶液生成草酸氧钛钡晶体,反应的化学方程式为:BaCl2+TiCl4+2H2C2O4+5H2O=BaTiO(C2O4)24H2O↓+6HCl,反应产生的HCl可循环使用,用来再溶解BaCO3;
(4)根据(3)方程式可知:草酸氧钛钡晶体是从含HCl的溶液中过滤出来的,若该晶体洗涤干净,则洗涤溶液中无Cl-,加入AgNO3溶液,不会产生白色沉淀。因此草酸氧钛钡晶体可用硝酸银检验沉淀是否洗涤干净;
(5)BaTiO(C2O4)24H2O煅烧,发生分解反应,生成高温下的气体产物有CO、CO2、H2O(g);
(6)根据题意可知在25.00mL溶液中含有Ba2+的物质的量是n(Ba2+)=(xC1 –yC2)×10-3mol,则a g样品得到的100.0 mL含Ba2+的物质的量是n(Ba2+)(总)=(xC1 –yC2)×10-3![]() mol=4(xC1 –yC2)×10-3mol;BaTiO3的摩尔质量为M g/mol,则含有的BaTiO3的质量为m(BaTiO3)= 4(xC1 –yC2)×10-3mol×Mg/mol= 4M(xC1 –yC2)×10-3g,样品质量为ag,故粉体中BaTiO3质量分数的表达式为:
mol=4(xC1 –yC2)×10-3mol;BaTiO3的摩尔质量为M g/mol,则含有的BaTiO3的质量为m(BaTiO3)= 4(xC1 –yC2)×10-3mol×Mg/mol= 4M(xC1 –yC2)×10-3g,样品质量为ag,故粉体中BaTiO3质量分数的表达式为:![]() 。
。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案【题目】请根据表中的信息回答下列问题
元素 | A | B | C | D | E |
有关信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 其原子M层有3个电子 | 食盐中的金属元素 | 单质在常温、常压下是黄绿色的气体 |
(1)D离子的结构示意图:________,B原子的电子式:________,E离子的电子式:________。
(2)和B元素的氢化物所含电子数相同的分子有多种,写出任意2种:________,________。
(3)A元素与E元素组成的化合物的电离方程式:_______________________。
【题目】中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:
实验 编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是__________________。
(2)根据上述数据,可计算出该盐酸的浓度约为___________(保留小数点后3位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用________操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___________。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥 C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视 E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、(1)浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为__________________;
(2)在0.01mol/L的NaHCO3溶液中的物料守恒表达式为___________________;
等浓度的NaHCO3 、Na2CO3混合溶液中的电荷守恒表达式为___________________;
(3)硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应的离子方程式为____________________;
(4)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是___________________。

