题目内容
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是( )
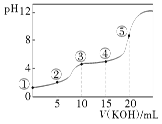
A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
D.点⑤所示溶液中:c(OH-)= c(H+)+ c(HC2O4-)+ c(C2O42-)
【答案】C
【解析】
此题考查溶液中的电荷守恒,根据溶液不带电这一特性,溶液中的阳离子和阴离子所带电荷相同,根据所加物质的原子间的关系进行书写物料守恒。
A. 根据电荷守恒得出,点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故A不正确,不符合题意。
B. 点③所示溶液中恰好反应生成KHC2O4,该溶液显酸性,故HC2O4-的电离程度大于其水解程度,故c(K+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),B不正确,不符合题意。
C. 点④所示溶液中,根据物料守恒得出c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1,C正确,符合题意。
D. 点⑤所示溶液为K2C2O4溶液,依据电荷守恒c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)和物料守恒c(K+) =2c(H2C2O4)+2c(HC2O4-)+2c(C2O42-),可得溶液中的质子守恒c(OH-)= c(H+)+ c(HC2O4-)+ 2c(H2C2O4),故D答案不正确,不符合题意。
故答案选C。

 阅读快车系列答案
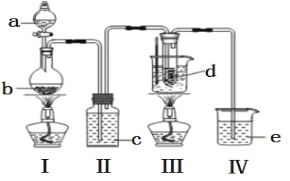
阅读快车系列答案【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
① | ② | ③ | II中实验现象 |
| |
A | 浓盐酸 | 碳酸钙 | 滴有酚酞的稀碳酸钠溶液 | 溶液由红色变为浅红色 | |
B | 浓氨水 | 氧化钙 | 硫酸亚铁溶液 | 产生大量白色沉淀 | |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 | |
D | NH4Cl溶液 | NaAlO2溶液 | 紫色石蕊试液 | 溶液由紫色变为蓝色 |
A. AB. BC. CD. D