题目内容
【题目】下列说法正确的是( )
A. 电解熔融金属氯化物制备Na、Mg、Al
B. 配制![]() 溶液时需加入稀硝酸防止水解
溶液时需加入稀硝酸防止水解
C. “一带一路”中的丝绸的主要成分是天然纤维素,属于高分子化合物。
D. 牙齿的矿物质Ca5(PO4)3OH+F-![]() Ca5(PO4)3F+OH-,故使用含氟牙膏可以防止龋齿的形成
Ca5(PO4)3F+OH-,故使用含氟牙膏可以防止龋齿的形成
【答案】D
【解析】
A. AlCl3是共价化合物,不能通过电解熔融AlCl3制备Al,故A错误;
B. Fe2+能被稀硝酸氧化为Fe3+,故B错误;
C.丝绸的主要成分是蛋白质,不是天然纤维素,故C错误;
D. 由平衡Ca5(PO4)3OH+F-![]() Ca5(PO4)3F+OH-可知,增大F-浓度,平衡正向移动,生成更难溶的氟磷灰石,氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀,故使用含氟牙膏可以防止龋齿的形成,故D正确。
Ca5(PO4)3F+OH-可知,增大F-浓度,平衡正向移动,生成更难溶的氟磷灰石,氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀,故使用含氟牙膏可以防止龋齿的形成,故D正确。
故选D。

【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示![]() 已知A、B、C均为气体
已知A、B、C均为气体![]() 。
。

(1)该反应的化学方程式为_______________。
(2)反应开始至2分钟时,B的平均反应速率为_______________。
(3)能说明该反应已达到平衡状态的是_______________。
A.v(A)=2v(B)
B.容器内气体密度不变
C.v逆(A)=v正(C)
D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______________。
(5)下表是该小组研究影响过氧化氢H2O2分解速率的因素时采集的一组数据:用![]() 制取
制取![]() 所需的时间
所需的时间![]() 秒
秒![]()
30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360s | 480s | 540s | 720s |
MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
①该研究小组在设计方案时。考虑了浓度、_______________、_______________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?_______________。
(6)将质量相同但聚集状态不同的![]() 分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定果如下:
分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定果如下:
催化剂 | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出![]() 发生分解的化学反应方程式_______________。
发生分解的化学反应方程式_______________。
②实验结果说明催化剂作用的大小与_______________有关。
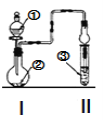
【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
① | ② | ③ | II中实验现象 |
| |
A | 浓盐酸 | 碳酸钙 | 滴有酚酞的稀碳酸钠溶液 | 溶液由红色变为浅红色 | |
B | 浓氨水 | 氧化钙 | 硫酸亚铁溶液 | 产生大量白色沉淀 | |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 | |
D | NH4Cl溶液 | NaAlO2溶液 | 紫色石蕊试液 | 溶液由紫色变为蓝色 |
A. AB. BC. CD. D