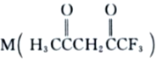题目内容
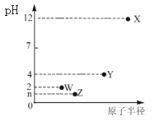
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。
【答案】3X(g)+Y(g)2Z(g) 1.8×103mol/(L·s) 946
【解析】
(1)由图中所给数据看,反应开始前,X、Y的物质的量都为1.0mol,而Z的物质的量为0,所以X、Y为反应物,Z为生成物;当各物质的量不变时,其物质的量都大于0,表明反应为可逆反应;再由物质的量的变化量之比等于化学计量数之比,可确定反应的化学计量数关系,从而写出反应方程式。
(2)从表中数据可得出,反应生成n(NH3)= 0.36mol,则参加反应的n(N2)= 0.18mol,从而求出0~50s内的平均反应速率v(N2)。
(3)利用H=E(N≡N)+3E(H-H)-6E(N-H),可求出E(N≡N)。
(1)由图中所给数据可得出,X、Y、Z的变化量分别为0.3mol、0.1mol、0.2mol,从而得出三者的物质的量之比为3:1:2,结合上面分析,可得出该反应的化学方程式为3X(g)+Y(g)2Z(g)。答案为:3X(g)+Y(g)2Z(g);
(2)从表中数据可得出,反应生成n(NH3)= 0.36mol,则参加反应的n(N2)=0.18mol,从而得出0~50s内的平均反应速率v(N2)=![]() = 1.8×103mol/(L·s)。答案为:1.8×103mol/(L·s);
= 1.8×103mol/(L·s)。答案为:1.8×103mol/(L·s);
(3)利用H=E(N≡N)+3E(H-H)-6E(N-H),可求出E(N≡N)=H-3E(H-H)+6E(N-H)=- 46×2kJ/mol-3×436kJ/mol+6×391kJ/mol=946 kJ/mol。答案为:946。

 阅读快车系列答案
阅读快车系列答案【题目】某反应在体积为5L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示![]() 已知A、B、C均为气体
已知A、B、C均为气体![]() 。
。

(1)该反应的化学方程式为_______________。
(2)反应开始至2分钟时,B的平均反应速率为_______________。
(3)能说明该反应已达到平衡状态的是_______________。
A.v(A)=2v(B)
B.容器内气体密度不变
C.v逆(A)=v正(C)
D.各组分的物质的量相等
E. 混合气体的平均相对分子质量不再改变的状态
(4)由图求得平衡时A的转化率为_______________。
(5)下表是该小组研究影响过氧化氢H2O2分解速率的因素时采集的一组数据:用![]() 制取
制取![]() 所需的时间
所需的时间![]() 秒
秒![]()
30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360s | 480s | 540s | 720s |
MnO2催化剂、加热 | 10s | 25s | 60s | 120s |
①该研究小组在设计方案时。考虑了浓度、_______________、_______________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?_______________。
(6)将质量相同但聚集状态不同的![]() 分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定果如下:
分别加入到5mL5%的双氧水中,并用带火星的木条测试。测定果如下:
催化剂 | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出![]() 发生分解的化学反应方程式_______________。
发生分解的化学反应方程式_______________。
②实验结果说明催化剂作用的大小与_______________有关。
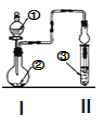
【题目】利用图示装置进行实验,反应进行足够长时间后装置II中实验现象正确的是
① | ② | ③ | II中实验现象 |
| |
A | 浓盐酸 | 碳酸钙 | 滴有酚酞的稀碳酸钠溶液 | 溶液由红色变为浅红色 | |
B | 浓氨水 | 氧化钙 | 硫酸亚铁溶液 | 产生大量白色沉淀 | |
C | 冰醋酸 | 乙醇和浓硫酸 | 饱和碳酸钠溶液 | 溶液分层,上层为油状液体 | |
D | NH4Cl溶液 | NaAlO2溶液 | 紫色石蕊试液 | 溶液由紫色变为蓝色 |
A. AB. BC. CD. D