题目内容
【题目】合成氨和制硫酸是中学阶段重要的化工生产反应。
(1)硫酸工业生产中接触室内发生的反应方程式为___;在实际生产过程中,操作温度选定400-500摄氏度,压强采用常压的原因分别是___。
(2)合成氨反应生成的氨气可用于工业制纯碱,写出以氨气、氯化钠、二氧化碳、水为原料制备纯碱的化学方程式___、___。
(3)合成氨每生成1g液氨,放出QkJ的热量,写出热化学反应方程式___。
(4)常用浓氨水来检查输氯管道是否泄漏,泄漏处会观察到大量的白烟(NH4Cl),还生成一种无色无味的单质气体,写出此反应的化学方程式并标出电子转移的方向和数目____,该反应中被还原的是___,还原产物是___。
【答案】2SO2+O2![]() 2SO3 选用400~500摄氏度的原因是因为在该温度范围内催化剂的活性最高,常压下SO2的转化率已经足够了,若增加压强,需要采用特种设备,增加成本 NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓ 2NaHCO3
2SO3 选用400~500摄氏度的原因是因为在该温度范围内催化剂的活性最高,常压下SO2的转化率已经足够了,若增加压强,需要采用特种设备,增加成本 NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓ 2NaHCO3![]() Na2CO3+H2O+CO2↑ N2(g)+3H2(g)
Na2CO3+H2O+CO2↑ N2(g)+3H2(g)![]() 2NH3(l)+34Q(Q>0)
2NH3(l)+34Q(Q>0)  氯气 氯化铵
氯气 氯化铵
【解析】
(1)接触室内二氧化硫和氧气反应生成三氧化硫,反应的方程式是2SO2+O2![]() 2SO3;400~500摄氏度时催化剂的活性最高,常压下SO2的转化率已经足够了,若增加压强,需要采用特种设备,增加成本,所以操作温度选定400-~500摄氏度,压强采用常压。
2SO3;400~500摄氏度时催化剂的活性最高,常压下SO2的转化率已经足够了,若增加压强,需要采用特种设备,增加成本,所以操作温度选定400-~500摄氏度,压强采用常压。
(2)氨气、氯化钠、二氧化碳、水反应生成氯化铵和碳酸氢钠沉淀,碳酸氢钠加热分解为碳酸钠、水、二氧化碳,反应方程式是NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓、2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(3)每生成1g液氨,放出QkJ的热量,则生成2mol液氨放热34QkJ,反应的热化学方程式是N2(g)+3H2(g)![]() 2NH3(l)+34Q(Q>0)
2NH3(l)+34Q(Q>0)
(4)氨气和氯气反应生成氯化铵和氮气,反应方程式是![]() ,氯元素化合价由0降低为-1,氮元素化合价由-3升高为0,电子转移的方向和数目是
,氯元素化合价由0降低为-1,氮元素化合价由-3升高为0,电子转移的方向和数目是 ;氯元素化合价由0降低为-1,氯气被还原,氯气被还原为氯化铵,还原产物是氯化铵。
;氯元素化合价由0降低为-1,氯气被还原,氯气被还原为氯化铵,还原产物是氯化铵。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.制备PCl3
(1)实验室用高锰酸钾和浓盐酸反应制氯气。发生装置可以是图中的____(填字母代号)。
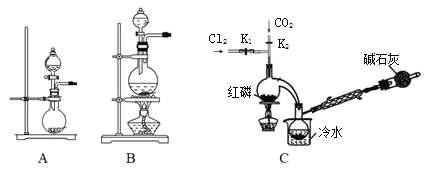
(2)检查装置C气密性并装入药品后,先关闭K1,打开K2通入干燥的CO2,一段时间后,关闭K2,加热曲颈瓶同时打开K1通入干燥氯气,反应立即进行。图中碱石灰的作用是______________。
II.实验室制备POCl3。
采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:

资料:①Ag++SCN﹣=AgSCN↓,Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | ﹣112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(3)POCl3在潮湿空气中会剧烈“发烟”,反应的化学方程式为___________________________________。
(4)反应温度要控制在60~65℃,原因是:_________________________________。
(5)通过佛尔哈德法可以测定产品中Cl元素含量,实验步骤如下:
a、准确称取15.0 g POCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
b、取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 molL﹣1 AgNO3标准溶液。
c、加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
d、以NH4Fe (SO4) 2为指示剂,用0.2 molL﹣1 NH4SCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去l0.00 mL NH4SCN溶液。
①步骤d中达到滴定终点的现象是__________________________________________。
②产品中Cl元素的质量分数为______________(保留3位有效数字)。
【题目】(10分)某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如下图所示,

则如图操作应在下图中的________(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |

(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会________。
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)表中元素原子半径最大的是(写元素符号)___,Y原子的电子排布式是__,Z原子核外电子能量最高的电子亚层是___。
(2)下列事实能说明Y元素的非金属性比S元素强的是___;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1mol Y单质比1mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)CCl4是一种常见的有机溶剂,写出其电子式___,判断其属于含有___(填“极性”、“非极性”)共价键的____分子(填“极性”或“非极性”)。SiH4的沸点比CH4高,原因是___。
(4)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式说明产生该现象的原因:___,在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因____。

