题目内容
【题目】将11.5 g钠投入到89 g水中(足量),充分反应后所得溶液的密度为1.25 g·cm-3。
计算:(1)生成H2的体积(标准状况下) _______ 。
(2)所得溶液中溶质的物质的量浓度为多少________ ?
【答案】5.6 L 6.25 mol·L-1
【解析】
根据n=m÷M计算11.5g Na的物质的量,根据2Na+2H2O=2NaOH+H2↑,计算生成氢气、NaOH的物质的量,根据V=nVm计算氢气的体积;根据m=nM计算氢气的质量,溶液质量=m(Na)+m(水)-m(氢气),再根据V=m÷ρ计算溶液的体积,根据c=n÷V计算所得溶液物质的量浓度.
11.5g Na的物质的量:n(Na)=11.5g÷23g·mol-1=0.5mol,
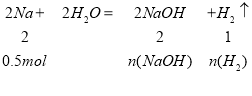
n(NaOH)=![]() =0.5mol
=0.5mol
n(H2)=![]() =0.25mol
=0.25mol
(1)标况下生成氢气的体积:V(H2)=0.25mol×22.4L·mol-1=5.6L;
(2)生成氢气的质量m((H2)=0.25mol×2g·mol-1=0.5g,
溶液质量=11.5g+89g-0.5g=100g,
溶液的体积=![]() =80mL,
=80mL,
溶液的物质的量浓度=![]() =6.25mol·L-1。
=6.25mol·L-1。

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目


