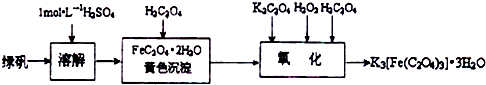
题目内容
16.亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水、和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如图所示.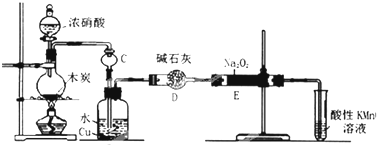
已知:室温下,①2NO+Na2O2═2NaNO2
②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+,5NO2-+2MnO4-+6H+═5NO3-+2Mn2++3H2O
(1)A中观察到的现象有红棕色气体生成.
(2)装置B中反应的离子方程式有3NO2+H2O=2H++2NO3-+NO↑,3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(3)装置C的作用:防止倒吸,装置F的作用:吸收未反应的NO.
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物Na2CO3、NaOH.(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒.已知亚硝酸钠能发生如下反应:2NaNO2+4HI═2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐.进行实验时,必须选用的物质有BE.
A.自来水 B.碘化钾淀粉试液 C.淀粉 D.白糖 E.食醋 F.白酒
(6)充分反应后,某同学设计实验对E中NaNO2的含量进行检测.称取E中固体2g,完全溶解配制成溶液100ml,取出25ml溶液用0.100mol/L酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),消耗KMnO4溶液20ml,求样品中亚硝酸钠的质量分数(保留小数点后1位)(已知:NaNO2摩尔质量69g/mol)
分析 装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置E中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气.
(1)A中生成二氧化氮;
(2)二氧化氮与水反应生成硝酸,铜能与稀硝酸反应;
(3)大肚瓶可防止倒吸,酸性高锰酸钾溶液可吸收未反应的NO;
(4)二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠;
(5)鉴别NaNO2和NaCl,利用2NaNO2+4HI═2NO+I2+2NaI+2H2O及碘遇淀粉变蓝分析;
(6)根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可求出亚硝酸钠的物质的量,然后求样品中亚硝酸钠的质量分数.
解答 解:装置A中是浓硝酸和碳加热发生的反应,反应生成二氧化氮和二氧化碳和水,装置B中是A装置生成的二氧化氮和水反应生成硝酸和一氧化氮,硝酸和铜反应生成硝酸铜,一氧化氮和水;通过装置E中的过氧化钠吸收一氧化氮、二氧化碳,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气.
(1)根据装置图可知,A中浓硝酸与木炭发生氧化还原反应生成CO2和NO2以及水,因此A中观察到的现象有红棕色气体生成,
故答案为:有红棕色气体生成;
(2)NO2溶于水生成NO和硝酸3NO2+H2O=2HNO3+NO↑,硝酸具有氧化性能把金属铜氧化,则装置B中反应的离子方程式有3NO2+H2O=2H++2NO3-+NO↑、3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3NO2+H2O=2H++2NO3-+NO↑;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)NO2极易溶于水与水反应,所以装置C的作用是防止倒吸;NO与过氧化钠反应后有剩余,随意排放容易引起大气污染,而NO能被酸性高锰酸钾溶液氧化,则装置F的作用吸收未反应的NO,
故答案为:防止倒吸;吸收未反应的NO;
(4)生成的NO中含有CO2和水蒸气,二者均能与过氧化钠反应,而碱石灰可以吸收CO2和水蒸气,所以如果没有D装置,则E中产物除亚硝酸钠外还含有副产物Na2CO3、NaOH,
故答案为:Na2CO3、NaOH;
(5)鉴别NaNO2和NaCl,由2NaNO2+4HI═2NO+I2+2NaI+2H2O及碘遇淀粉变蓝可知,则选择试剂为BE,
故答案为:BE;
(6)消耗高锰酸钾的物质的量是0.1mol/L×0.02L=0.002mol,则根据方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,亚硝酸钠的物质的量是0.002mol×$\frac{5}{2}$=0.005mol,则原样品中亚硝酸钠的物质的量是0.005mol×$\frac{100mL}{25mL}$=0.02mol,其质量为0.02mol×69g/mol=1.38g,所以样品中亚硝酸钠的质量分数$\frac{1.38g}{2g}$×100%=69.0%,
答:质量分数为69.0%.
点评 本题考查硝酸的性质、尾气处理、实验条件控制、实验方案设计与评价以及物质含量测定,注意实验过程中的反应现象分析,掌握基础是关键,题目难度中等.

| A. | Cl-→Cl2 | B. | Fe3+→Fe2+ | C. | KClO3→KCl | D. | KI→I2 |
| 相对分子量 | 密度(g/cm3) | 沸点(℃) | 水溶性 | |
| 2-羟基-4-苯基丁酸 | 180 | 1.219 | 357 | 微溶 |
| 乙 醇 | 46 | 0.789 | 78.4 | 易溶 |
| 2-羟基-4-苯基丁酸乙酯 | 208 | 1.075 | 212 | 难溶 |
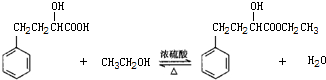
①如图1,在干燥的圆底烧瓶中加入20mL 2-羟基-4-苯基丁酸、20mL无水乙醇和适量浓硫酸,再加入几粒沸石;
②加热至70℃左右保持恒温半小时;
③分离、提纯三颈瓶中的粗产品,得到有机粗产品;
④精制产品.
请回答下列问题:
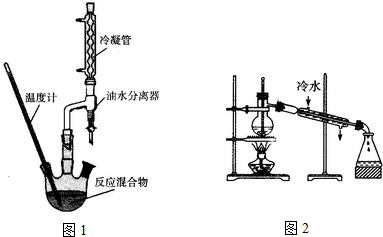
(1)油水分离器的作用为及时分离产物水,促进平衡向生成酯的反应方向移动
(2)本实验采用水浴加热,因为温度过高会使产率减小(填“增大”、“”减小”或“不变”)
(3)取三颈烧瓶中的混合物分别用水、饱和碳酸氢钠溶液和水洗涤.第二次水洗的目的是洗掉碳酸氢钠
(4)在精制产品时,加入无水MgSO4的作用为干燥;然后过滤,再利用如图2装置进行蒸馏纯化,图2装置中的错误有温度计水银球的位置,冷凝水的方向
(5)若按纠正后的操作进行蒸馏纯化,并收集212℃的馏分,得2-羟基-4-苯基丁酸乙酯约9.0g.则该实验的产率为32%.
| A. | 1L溶液中含有0.2NA个NO3- | |
| B. | 1L溶液中所含的阴、阳离子总数为0.6NA个 | |
| C. | 0.5L溶液中Ba2+浓度是0.1mol/L | |
| D. | 500mL溶液中,含有NO3-的物质的量为0.2mol |
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量NaHSO4固体,溶液的c(H+)增大,水电离的c(H+)降低 | |
| C. | 向水中加入少量NaOH固体,平衡逆向移动,溶液的c(OH-)降低 | |
| D. | 向水中加入少量NH4Cl固体,平衡正向移动,溶液的c(OH-)增大 |