题目内容
【题目】氧、硫、硒(Se)、碲(Te)、钋(Po)是元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1)硒在元素周期表中的位置________。
(2)![]() Po的中子数为________。
Po的中子数为________。
(3)某温度时,该族单质与H2反应生成气态H2X的热化学方程式如下:
O2(g)+2H2(g)=2H2O(g) △H1=-484 kJ/mol
S(g)+H2(g)![]() H2S(g) △H2=-20 kJ/mol
H2S(g) △H2=-20 kJ/mol
Se(g)+H2(g)![]() H2Se(g) △H3=+81kJ/mol
H2Se(g) △H3=+81kJ/mol
①硫和硒氢化物的热稳定性:H2S________ H2Se(填“>”、“=”或“<”);判断依据是________。
②写出O2(g)与H2S(g)反应生成H2O(g)和S(g)的热化学方程式________。
【答案】第四周期,第ⅥA族 125 > 同主族元素,从上到下,核电荷数增多,电子层数增加,原子半径增大,得电子能力减弱,气态氢化物稳定性减弱。(或依据△H可判断硫化氢能量小,物质更稳定。合理给分) 2H2S(g)+O2(g)=S(g)+2H2O(g) △H=-444 kJ/mol
【解析】
(1)Se是34号元素,根据其原子核外电子排布确定Se元素在周期表的位置;
(2)根据元素符号各个角标的含义及关系计算其中子数目;
(3)①物质含有的能量越低,物质的稳定性越强;
②根据盖斯定律,将第一个热化学方程式减去2乘以第二个热化学方程式,可得待求反应的热化学方程式。
(1)Se是34号元素,原子核外电子排布为2、8、18、6,原子核外电子层数等于元素的周期序数,原子核外最外层电子数等于其所在的主族序数,所以Se在周期表的位置是第四周期第VIA族;
(2)![]() Po质子数是84,质量数为209,由于质量数等于质子数与中子数的和,所以
Po质子数是84,质量数为209,由于质量数等于质子数与中子数的和,所以![]() Po原子的中子数为209-84=125;
Po原子的中子数为209-84=125;
(3)①S(g)+H2(g)![]() H2S(g) △H2=-20 kJ/mol,反应是放热反应;而Se(g)+H2(g)
H2S(g) △H2=-20 kJ/mol,反应是放热反应;而Se(g)+H2(g)![]() H2Se(g) △H3=+81kJ/mol是吸热反应,说明物质含有的能量高低顺序:H2Se(g)>H2S(g);物质含有的能量越低,物质的稳定性就越强,所以物质的稳定性:H2S(g) >H2Se(g);
H2Se(g) △H3=+81kJ/mol是吸热反应,说明物质含有的能量高低顺序:H2Se(g)>H2S(g);物质含有的能量越低,物质的稳定性就越强,所以物质的稳定性:H2S(g) >H2Se(g);
②(i)O2(g)+2H2(g)=2H2O(g) △H1=-484 kJ/mol
(ii)S(g)+H2(g)![]() H2S(g) △H2=-20 kJ/mol
H2S(g) △H2=-20 kJ/mol
(i)- 2×(ii),整理可得:2H2S(g)+O2(g)=S(g)+2H2O(g) △H=-444 kJ/mol。

 阅读快车系列答案
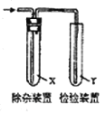
阅读快车系列答案【题目】欲用如图装置对所制备的气体进行除杂、检验,其设计方案合理的是( )
制备气体 | X(除杂试剂) | Y(检验试剂) |
| |
A | 生石灰与浓氨水 | 浓硫酸 | 红色石蕊试纸 | |
B | 电石与NaC1水溶液 | H2O | Br2的CCl4溶液 | |
C | C2H5OH与浓硫酸加热至170℃ | 饱和NaHSO3溶液 | K2Cr2O7酸性溶液 | |
D | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
A.AB.BC.CD.D
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如下表:下列说法正确的是( )
物质 | X | Y | Z |
初始浓度(mol/L) | 0.1 | 0.2 | 0 |
2min末浓度(mol/L) | 0.08 | a | b |
平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t℃时,2min末Y与Z的物质的量浓度:a=0.06mol/L,b=0.4mol/L
C.增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol/(L·min)
【题目】50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液反应,测定中和热。近似认为两溶液的密度都是1g/cm3,实验数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
中和后生成溶液的比热容c=4.18J/(g·℃),则中和热△H=___(取小数点后一位)