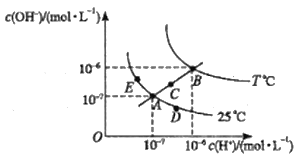
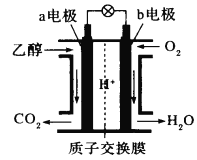
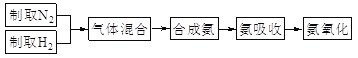
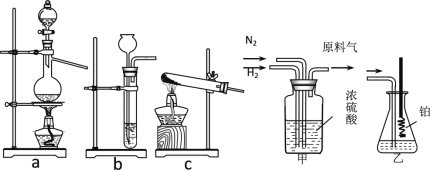
题目内容
【题目】50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液反应,测定中和热。近似认为两溶液的密度都是1g/cm3,实验数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
中和后生成溶液的比热容c=4.18J/(g·℃),则中和热△H=___(取小数点后一位)
【答案】-56.8kJ/mol
【解析】
两份溶液中,碱电离产生的OH-过量,所以应使用酸电离产生的H+的物质的量计算生成H2O的物质的量;计算反应的热效应时,混合溶液的质量接近100g,利用公式Q=cmt计算放出的热量,然后换算为生成1mol水放出的热量,即得中和热。
50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液混合,c(OH-)=0.55mol/L,c(H+)=0. 50mol/L,发生反应为H++OH-==H2O,所以OH-过量,生成n(H2O)=0. 50mol/L×0.05L=0.025mol。
四次实验中,第2次实验误差过大,舍去。另三次实验中,温度平均变化值为![]() ℃=3.4℃,Q=cmt=4.18J/(g·℃)×100g×3.4℃×10-3kJ/J=1.42kJ,则中和热△H= -
℃=3.4℃,Q=cmt=4.18J/(g·℃)×100g×3.4℃×10-3kJ/J=1.42kJ,则中和热△H= -![]() = -56.8kJ/mol。答案为:-56.8kJ/mol。
= -56.8kJ/mol。答案为:-56.8kJ/mol。

 阅读快车系列答案
阅读快车系列答案【题目】将一定量纯净的氨基甲酸胺(H2NCOONH4)固体,置于特制密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使反应: H2NCOONH4(s)![]() 2NH3(g)+CO2(g)达到分解平衡,实验测得不同温度及反应时间(t1<t2<t3)的有关表格:
2NH3(g)+CO2(g)达到分解平衡,实验测得不同温度及反应时间(t1<t2<t3)的有关表格:
氨基甲酸铵分解时温度、气体总浓度及反应时间的关系。
温度/℃ 气体总浓度(mol/L) 时间/min | 15 | 25 | 35 |
0 | 0 | 0 | 0 |
t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
(1)在25℃,0-t1时间内产生氨气的平均速率为___。
(2)根据表中数据换算出,15℃时合成反应2NH3(g)+CO2(g)![]() H2NCOONH4(s)平衡常数K约为___。
H2NCOONH4(s)平衡常数K约为___。
(3)以捕捉到的CO2与H2为原料可合成甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)![]() CH3OH(g)+H2(g) ΔH<0在恒温恒容的密闭容器中,加入1molCO2和3molH2,充分反应达平衡时放出热量akJ,若在原容器中加入2molCO2和6molH2,在相同温度下反应达平衡时放热bkJ,则a和b满足的关系___。
CH3OH(g)+H2(g) ΔH<0在恒温恒容的密闭容器中,加入1molCO2和3molH2,充分反应达平衡时放出热量akJ,若在原容器中加入2molCO2和6molH2,在相同温度下反应达平衡时放热bkJ,则a和b满足的关系___。
【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为_______________________。
(2)滤渣1的主要成分除SiO2外还有___________;氧化除杂工序中ZnO的作用是____________,若不通入氧气,其后果是________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________;沉积锌后的电解液可返回_______工序继续使用。