题目内容
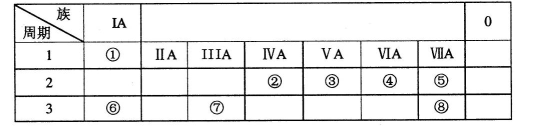
X、Y、Z、T、W五种元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_______;W元素基态原子电子排布式为________________________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是______________。
A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的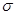 键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4. 4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为______________。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化曲线如下图所示:
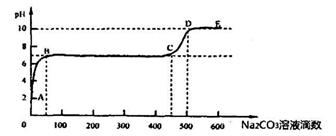
请用离子方程式表示BC段、CD段发生的反应:
BC段:__________________________________________;
CD段:__________________________________________。
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_______;W元素基态原子电子排布式为________________________。
(2)元素Z与元素T相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是______________。
A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
(3)常见溶剂XZ2的分子中,含有的
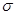 键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________(4)①自然界常见的X元素含氧酸的钙盐和适量T的氢化物溶液反应时,每产生4. 4g 气体(不考虑气体溶解)放热a kJ,则该反应的热化学方程式为______________。
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化曲线如下图所示:

请用离子方程式表示BC段、CD段发生的反应:
BC段:__________________________________________;
CD段:__________________________________________。
(1)
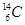 或14C (1分) 1s22s22p63s23p63d54s1或[Ar]3d54s1(2分)
或14C (1分) 1s22s22p63s23p63d54s1或[Ar]3d54s1(2分)(2)Cl (1分) B、D(2分)
(3)1:1(或答1)(1分) 分子晶体(1分) Y的氢化物(氨)分子间存在氢键作用(1分)
(4)①CaCO3(s)+2HCl(aq)=CaCl2(aq)+CO2(g)+H2O(l) ΔH=-10aKJ/mol(2分)
②Ca2++ CO32-=CaCO3↓(2分)
CO32-+H2O
 HCO3-+OH-(2分)
HCO3-+OH-(2分)试题分析:根据题意可知X、Y、Z、T、W分别为C、N、S、Cl、Cr;
(1)14C常用来测定文物年代,Cr的基态原子电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1;
(2)S和Cl相比非金属性较强的Cl,选项中A、C不能作为判断非金属性强弱的依据,而B、D中氢化物的稳定性、电负性可以作为判断依据;
(3)CS2分子中含有2个σ键与2个π键,个数比为1:1,属分子晶体,N的常见氢化物(如氨气)易液化的主要是因为分子间存在氢键;
(4)生成0.1mol二氧化碳放出aKJ的热量,故反应热为-10aKJ/mol;开始溶液中有过量的算,滴加碳酸钠,发生反应,pH升高,后来钙离子与碳酸根结合生成碳酸钙沉淀,钙离子反应完后,再加入碳酸根,发生水解,pH升高。

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目

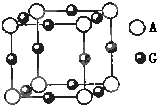 。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。