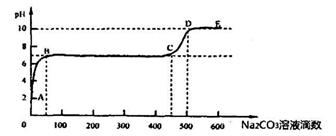
题目内容
X、Y、Z、W是元素周期表前四周期常见的四种元素,原子序数依次增大。X的单质既有σ键乂有π键,且X的第一电离能比其相邻元素都大,Y的电负性比X的小,其基态原子最外层的p电子是该层s电子的两倍,Z是前36号元素中原子半径最大的主族元素,W的一种核素的质量数是56,中子数是30。
(1) Y位于元素周期表第_______周期第_______族,W2+的核外电子排布式是______。
(2) X的氧化物XO2与H2O比较,熔点较高的是_______ (填化学式),Z的氢化物属于 晶体,Z2O2的化学键类型是_______(填编号)
(3)加热条件下,Y的单质与足量的X的最高价氧化物的水化物的浓溶液反应,生成Y的最髙价含氧酸,写出此反应的化学方程式_______.
(4)在250C,101kPa下,W的单质在氧气中燃烧后恢复至原温度和压强,平均每转移1mol电子放出QkJ的热量,则W单质燃烧的热化学方程式是_______。
(1) Y位于元素周期表第_______周期第_______族,W2+的核外电子排布式是______。
(2) X的氧化物XO2与H2O比较,熔点较高的是_______ (填化学式),Z的氢化物属于 晶体,Z2O2的化学键类型是_______(填编号)
| A.离子键 | B.极性共价键 | C.非极性共价键 | D.金属键 |
(4)在250C,101kPa下,W的单质在氧气中燃烧后恢复至原温度和压强,平均每转移1mol电子放出QkJ的热量,则W单质燃烧的热化学方程式是_______。
(15分)
(1)三 ⅥA (2分) 1s22s22p63s23p63d6(2分)
(2)H2O (2分) 离子(2分) AC(2分)
(3)S+6HNO3(浓)=H2SO4+6NO2↑+2H2O(2分)
(4)3Fe(s)+ 2O2(g)= Fe3O4(s) △H =" -" 8Q KJ/mol(3分)
(1)三 ⅥA (2分) 1s22s22p63s23p63d6(2分)
(2)H2O (2分) 离子(2分) AC(2分)
(3)S+6HNO3(浓)=H2SO4+6NO2↑+2H2O(2分)
(4)3Fe(s)+ 2O2(g)= Fe3O4(s) △H =" -" 8Q KJ/mol(3分)
试题分析:根据题意可以确定X、Y、Z、W分别为N、O、K、Fe;
(1)因Y的电负性比X的电负性小,故Y不可能为O,故为S;Fe2+的电子排布式,先失去4s电子。
(2)H2O因存在氢键,故熔沸点较高;金属的氢化物为离子晶体;K2O2中既有离子键又有非极性共价键
(3)S与浓硝酸的反应,还原产物为NO2;
(4)从反应方程式中可以看出,转移了8mol电子,故△H =" -" 8Q KJ/mol

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目

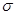 键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________
键与π键个数比为_______,它所形成的晶体类型为_______;Y的常见氢化物易液化的主要原因是______________